Estratégias Neoadjuvantes e Reestadiamento no Adenocarcinoma de Pâncreas Borderline Ressecável: Uma Abordagem Multidisciplinar
O adenocarcinoma ductal pancreático (ADP) permanece como uma das neoplasias de maior letalidade, primariamente devido ao seu diagnóstico tardio e comportamento biológico agressivo. Dentro do espectro de doença localizada, a categoria borderline resectable pancreatic cancer (BRPC) representa um desafio clínico e cirúrgico único. Estes tumores, pela sua íntima relação com estruturas vasculares críticas, apresentam altas taxas de margens cirúrgicas comprometidas (R1) quando a ressecção cirúrgica é a abordagem primária.
Este post detalha a estratégia contemporânea de manejo, focada na terapia neoadjuvante e nos critérios de reestadiamento para otimizar os desfechos oncológicos.
1. Estratificação de Ressecabilidade: A Definição Atual de Borderline
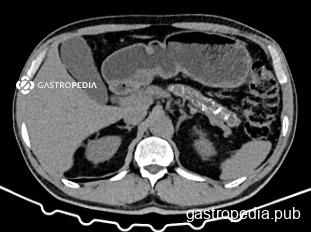
Uma estratificação anatômica precisa, baseada em tomografia computadorizada com contraste em protocolo pancreático, é o pilar para o planejamento terapêutico. De acordo com as diretrizes mais atuais (como as do NCCN – National Comprehensive Cancer Network), a classificação de BRPC é definida por contatos vasculares específicos:
- Envolvimento Venoso (Veia Mesentérica Superior/Veia Porta):
- Contato do tumor sólido com a VMS ou VP >180°.
- Contato ≤180° associado a irregularidade do contorno venoso ou trombose, desde que haja segmento vascular proximal e distal adequados que permitam uma ressecção segura e completa com reconstrução venosa.
- Contato do tumor sólido com a veia cava inferior (VCI).
- Envolvimento Arterial:
- Contato com a artéria hepática comum sem extensão ao tronco celíaco ou à bifurcação da artéria hepática, permitindo ressecção e reconstrução.
- Contato com a artéria mesentérica superior (AMS) ≤180°.
2. O Racional da Terapia Neoadjuvante Sistêmica
Para pacientes com BRPC, a terapia sistêmica em regime neoadjuvante (ou de indução) tornou-se o padrão-ouro.
Os objetivos são múltiplos:
- Tratamento de Micrometástases: Erradicar a doença subclínica sistêmica, a principal causa de recidiva precoce.
- Downstaging Tumoral: Reduzir o envolvimento tumoral nas interfaces vasculares, aumentando a probabilidade de uma ressecção R0.
- Seleção Biológica: Identificar pacientes com doença de progressão rápida durante a quimioterapia, que não se beneficiariam de uma cirurgia de grande porte.
Os regimes quimioterápicos mais utilizados são o FOLFIRINOX (ácido folínico, fluorouracil, irinotecano, oxaliplatina) e a combinação de Gemcitabina com nab-paclitaxel. A escolha é individualizada com base no performance status e comorbidades do paciente. A duração do tratamento é tipicamente de 4 a 6 meses, seguida por um reestadiamento criterioso.
Existe atualmente discussão na literatura sobre a possível indicação de terapia neoadjuvante mesmo para as lesões classificadas como ressecáveis, especialmente quando há marcadores de pior prognóstico / comportamento mais agressivo, tais como CA 19-9 elevado ou linfonodomegalias peripancreáticas.
3. Reestadiamento e Avaliação de Resposta Pós-Terapia Sistêmica
Após a conclusão da terapia de indução, a avaliação da resposta para determinar a elegibilidade para a cirurgia é um processo multimodal e complexo.
- Avaliação Metabólica com PET/CT (¹⁸F-FDG): O PET/CT é fundamental para avaliar a resposta metabólica. Uma redução significativa ou a normalização do SUVmax (Standardized Uptake Value) no sítio primário e a ausência de novas lesões hipermetabólicas são fortes indicadores de resposta favorável e preditores de melhores desfechos.
- Avaliação Bioquímica com CA 19-9: O antígeno carboidrato 19-9 é um marcador tumoral sérico essencial. Uma queda >50% em relação ao valor basal, ou a sua normalização, constitui uma resposta bioquímica positiva. A falha na redução ou o aumento do CA 19-9 durante a terapia neoadjuvante é um sinal de alerta para progressão de doença ou quimiorresistência.
4. A Decisão Cirúrgica: O Objetivo é a Ressecção R0
Pacientes que demonstram resposta radiológica, metabólica e bioquímica, sem evidência de doença metastática, são considerados candidatos à exploração cirúrgica. A pancreatectomia pós-terapia neoadjuvante é um procedimento tecnicamente exigente, frequentemente complicado por fibrose e desmoplasia.
A escolha da via de acesso — aberta, laparoscópica ou robótica — permanece um tópico de intenso debate na comunidade cirúrgica. Embora centros de alto volume demonstrem a viabilidade de abordagens robóticas para casos selecionados, não há consenso definitivo sobre a superioridade de uma via em detrimento da outra em termos de desfechos oncológicos a longo prazo para BRPC. O objetivo primordial e inegociável é a obtenção de uma ressecção R0 com linfadenectomia adequada, independentemente da plataforma cirúrgica utilizada. A decisão deve ser baseada na experiência do centro, na expertise da equipe cirúrgica e nas características individuais do paciente e do tumor.
Conclusão
O manejo do adenocarcinoma de pâncreas borderline ressecável evoluiu para um paradigma multidisciplinar complexo, onde a terapia neoadjuvante é central. A estratificação precisa, o uso de regimes quimioterápicos eficazes e uma avaliação de resposta multimodal são cruciais para selecionar os pacientes que mais se beneficiarão da ressecção cirúrgica. O sucesso cirúrgico, definido pela margem R0, continua sendo o fator prognóstico modificável mais importante, e sua busca deve guiar a estratégia técnica, reconhecendo o debate existente sobre as diferentes vias de acesso.
Referências
- Mokadem M, et al. Defining and Predicting Early Recurrence in 957 Patients With Resected Pancreatic Ductal Adenocarcinoma. Annals of Surgery. 2021;273(4):780-788.
- Versteijne E, et al; Dutch Pancreatic Cancer Group. Preoperative Chemoradiotherapy Versus Immediate Surgery for Resectable and Borderline Resectable Pancreatic Cancer (PREOPANC): A Randomized, Controlled, Multicenter Phase III Trial. The Lancet Oncology. 2020;21(9):1199-1210.
- Tsai S, et al. Neoadjuvant FOLFIRINOX in Patients With Borderline Resectable Pancreatic Cancer: A Systematic Review and Patient-Level Meta-Analysis. JAMA Surgery. 2020;155(5):422-431.
Como citar este artigo
de Meira Junior, JD. Estratégias Neoadjuvantes e Reestadiamento no Adenocarcinoma de Pâncreas Borderline Ressecável: Uma Abordagem Multidisciplinar Gastropedia; 2025 Vol 2. Disponível em: https://gastropedia.pub/pt/gastroenterologia/estrategias-neoadjuvantes-e-reestadiamento-no-adenocarcinoma-de-pancreas-borderline-ressecavel-uma-abordagem-multidisciplinar/