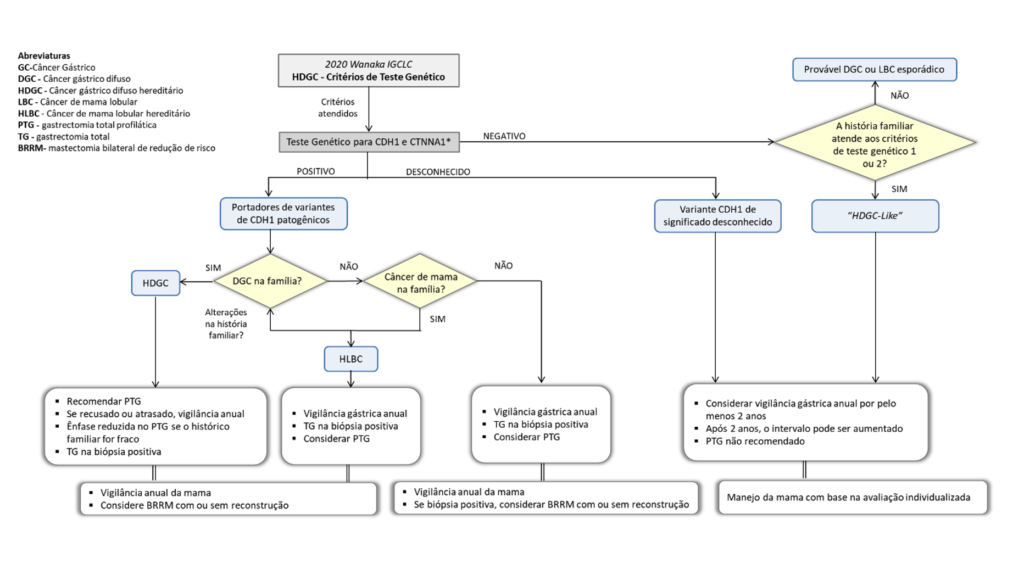
Como tratar o Helicobacter pylori? Entendendo como escolher o esquema de primeira linha
O Helicobacter pylori (H. pylori) é a infecção bacteriana crônica mais prevalente do mundo, acometendo mais de metade da população. Associa-se com gastrite crônica, que pode progredir para complicações graves, como úlcera péptica, adenocarcinoma e linfoma MALT.
Pelas evidências atuais, a sua erradicação tem sido recomendada de forma mais ampla, mesmo na ausência de sintomas em muitas situações. As principais referências que norteiam a conduta do H. pylori em nosso país são:
- IV Consenso Brasileiro (2018)
- Consenso Maastricht VI / Florence (2022)
Uma das mais importantes causas de falha à erradicação do H. pylori é o aumento da resistência à claritromicina e levofloxacino. A resistência aos nitroimidazóicos também é comum. Por outro lado, a resistência à amoxicilina e à tetraciclina é baixa e estável. Esses conceitos são importantes tanto quando pensamos em esquemas de primeira linha como em esquema de retratamento.
A escolha do esquema inicial de tratamento para o H pylori considera dois principais aspectos:
- Taxa local de resistência à claritromicina
- Histórico de alergia medicamentosa
Seria interessante a realização de teste de susceptibilidade (molecular ou cultura) antes da prescrição de antibióticos, mas sabemos que estes métodos ainda são extremamente escassos (ou mesmo quase inexistentes) na nossa prática diária brasileira.
Em áreas em que há baixa resistência à claritromicina (< 15%), o tratamento empírico de primeira linha deve ser a terapia tripla com claritromicina ou a quádrupla com bismuto. Alguns poucos estudos avaliaram o perfil de resistência do H. pylori no Brasil, identificando resistência de 2.5 a 16.9% à claritromicina, 5 a 23% às fluoroquinolonas, aproximadamente 50% ao metronidazol e duplas resistência à claritromicina e metronidazol de 7.5 a 10%. Diante disso, a tendência do Consenso Brasileiro ainda é considerar o Brasil como uma área de baixa resistência à claritromicina.
Desde o Maastricht V (2017) e o IV Consenso Brasileiro (2018), uma importante mudança nas recomendações de tratamento para o H. pylori foi o aumento da duração de 7 para 14 dias na tentativa de aumentar a taxa de erradicação diante da crescente elevação de resistência bacteriana.
Os esquemas de primeira linha propostos em nosso país, portanto, são os seguintes:
- Esquema recomendado: OAC – Terapia tripla padrão com claritromicina

- Esquema alternativo: BOTM – Terapia quádrupla com bismuto

- Outro esquema alternativo: OACM – Terapia quádrupla concomitante sem bismuto. É uma opção em áreas de maior resistência comprovada à claritromicina quando o bismuto não for disponível.

Por falar em disponibilidade de subcitrato de bismuto coloidal, essa medicação tem sido bem pouco disponível em nosso país. Atualmente, é possível conseguir apenas por meio de manipulação (e mesmo assim com certa dificuldade). Isso nos faz lembrar da furazolidona, que já foi muito utilizada em esquemas para tratamento de H. pylori, mas que não é comercializada há anos em nosso país.
Alergia à penicilina
A erradicação do H. pylori em pacientes com alergia à penicilina (relatada em até 3 a 10% das pessoas) é um desafio. O ideal seria realmente comprovar que essa alergia é verdadeira para ter à disposição os esquemas com amoxicilina.
Pelo Consenso Brasileiro, são dois os esquemas principais:
- Terapia tripla com levofloxacino em substituição à amoxicilina (OCL)

- Terapia quádrupla com bismuto (BOTM), conforme já citada previamente
Efeitos adversos
Infelizmente, até 50% dos pacientes apresentam efeitos colaterais com o tratamento do H. pylori. Em menos de 10%, esses efeitos são limitantes e levam à interrupção da terapia. É importante, portanto, sempre orientar bem os pacientes dos efeitos adversos mais comuns para aumentar a adesão:
- Amoxicilina: Diarreia, rash cutâneo
- Claritromicina: náuseas, vômitos, dor abdominal, gosto metálico, raramente prolongamento QT
Usar probióticos ajuda?
Os probióticos (como Lactobacilli e Saccharomyces boulardii) reduzem os efeitos adversos associados à terapia de erradicação e, com isso, podem aumentar a adesão. Há estudos sobre efeitos diretos sobre o H. pylori, mas ainda são necessários mais dados.
Preciso fazer controle de cura? Quando?
Sim. Deve ser realizado pelo menos 4 semanas após o tratamento. O ideal é preferir método não invasivos, reservando-se a endoscopia apenas se indicada por outra razão (ex: controle de cura de úlcera gástrica).
Conclusão
O H. pylori é extremamente comum e sua erradicação pode ser muitas vezes um desafio. A terapia tripla padrão (OAC) no Brasil fornece taxas de cura acima de 80% e ainda é a mais utilizada. Devemos, contudo, estar atentos aos crescentes níveis de resistência bacteriana para atualizarmos constantemente nossas recomendações.
Como citar este artigo
Lages RB. Como tratar o Helicobacter pylori? Entendendo como escolher o esquema de primeira linha. Gastropedia 2022. Disponível em https://gastropedia.pub/pt/gastroenterologia/estomago/como-tratar-helicobacter-pylori
Referências
[1] Malfertheiner P, Megraud F, Rokkas T, Gisbert JP, Liou JM, Schulz C, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut 2022;71:1724–62. doi:10.1136/gutjnl-2022-327745.
[2] Coelho LGV, Marinho JR, Genta R, Ribeiro LT, Passos M CF, Zaterka S, et al. IVth Brazilian Consensus Conference on Helicobacter pylori infection. Arq Gastroenterol 2018;55:97–121. doi:10.1590/s0004-2803.201800000-20.