¿Como Diagnosticar Correctamente la Enfermedad Celíaca?
La enfermedad celíaca (EC) se define como una respuesta inmunomediada y permanente al gluten, proteína presente en el trigo, la cebada y el centeno. Se trata de una enfermedad caracterizada por inflamación en la mucosa del intestino delgado, con atrofia vellositaria e hiperplasia de criptas, que ocurre por la exposición de la mucosa al gluten y mejora tras la retirada de esta proteína de la dieta (conozca más sobre la patogenia de la enfermedad celíaca en este post: patogenese da doenca celiaca). Presenta un amplio espectro de manifestaciones clínicas y el diagnóstico se realiza a través de pruebas serológicas y biopsias duodenales por endoscopia digestiva alta (EDA).
¿Quién debe ser evaluado?
- El cribado poblacional para individuos asintomáticos no es recomendado;
- El cribado en individuos asintomáticos que tengan un pariente de primer grado confirmado debe ser considerado;
- Pacientes con síntomas gastrointestinales sugestivos, a saber:
- Alteración del hábito intestinal como diarrea crónica o estreñimiento;
- Síndrome de malabsorción;
- Pérdida de peso inexplicable;
- Dolor abdominal;
- Distensión o bloating;
- Dispepsia refractaria;
- Síndrome del intestino irritable;
- Intolerancia a la lactosa refractaria.
- Pacientes con síntomas extra-intestinales sugestivos, a saber:
- Anemia por deficiencia de hierro, folato o vitamina B12;
- Alteración de enzimas hepáticas;
- Dermatitis herpetiforme;
- Fatiga;
- Cefalea recurrente;
- Pérdida fetal recurrente;
- Hijos con bajo peso al nacer;
- Infertilidad;
- Estomatitis aftosa persistente;
- Hipoplasia del esmalte dental;
- Enfermedades óseas metabólicas y osteoporosis precoz;
- Neuropatía periférica idiopática;
- Ataxia cerebelar no hereditaria.
Pruebas diagnósticas
Las pruebas diagnósticas deben realizarse mientras el paciente esté consumiendo gluten normalmente en la dieta.
El enfoque diagnóstico se basa en el riesgo del paciente para enfermedad celíaca:
- Baja probabilidad
- Ausencia de signos y síntomas sugestivos de malabsorción, como diarrea crónica/esteatorrea o pérdida de peso;
- Ausencia de historia familiar de EC;
- Descendientes de chinos, japoneses o del África subsahariana.
- Alta probabilidad
- Presencia de síntomas altamente sugestivos de EC como diarrea crónica/esteatorrea y pérdida de peso;
- Individuos que presenten ambos hallazgos a continuación:
- Factores de riesgo que los coloquen como moderado a alto riesgo para EC: pariente de primer o segundo grado con EC, DM tipo 1, tiroiditis autoinmune, síndrome de Down y Turner, hemosiderosis pulmonar (riesgo moderado);
- Síntomas gastrointestinales o extra-intestinales sugestivos de EC (descritos arriba).
¿Cómo evaluar?
- Individuos con baja probabilidad: pruebas serológicas. El anti-transglutaminasa inmunoglobulina A (anti-tTG IgA) y el anti-endomisio IgA tienen sensibilidad similar. Resultados negativos en cualquiera de estas pruebas en individuos con bajo riesgo para EC tienen un alto valor predictivo negativo y evitan la necesidad de biopsias. Ya los pacientes con pruebas serológicas positivas deben ser sometidos a EDA con biopsias duodenales.
- Individuos con alta probabilidad: pruebas serológicas y múltiples biopsias duodenales deben ser realizadas. Las biopsias duodenales en este grupo deben ser efectuadas independientemente del resultado de las pruebas serológicas.
Sobre las pruebas serológicas
- La serología es un componente crucial para diagnóstico de EC;
- Ninguna prueba serológica es 100% específica para enfermedad celíaca;
- Anti-tTG IgA es el anticuerpo más solicitado para el diagnóstico en adultos y debe ser realizado con IgA sérica para descartar deficiencia de IgA;
- Pacientes sometidos a EDA para investigación de cuadros dispépticos y cuyo duodeno fue biopsiado por hallazgos de atrofia deben ser evaluados con anti-tTG IgA e IgA sérica;
- Si el paciente tiene alta probabilidad de EC, EDA con biopsias duodenales deben ser realizadas incluso con serología negativa;
- En pacientes con deficiencia de IgA, la serología con IgG debe ser realizada: comúnmente anti-gliadina deaminada o anti-tTG.
Sobre biopsias duodenales
- Se necesitan 1 a 2 fragmentos del bulbo (posición 9 o 12 horas) y al menos 4 fragmentos de la segunda porción duodenal para el correcto diagnóstico de EC;
- La EDA también es importante para diagnóstico diferencial de otras síndromes de malabsorción o enteropatías;
- Duodenitis linfocítica (> 25 linfocitos/100 células epiteliales) en ausencia de atrofia vellositaria no es específica para EC y otros diagnósticos deben ser considerados, como: infección por H. Pylori, uso de antiinflamatorios no esteroideos u otras medicaciones, sobrecrecimiento bacteriano del intestino delgado, sensibilidad no celíaca al gluten, otras enfermedades autoinmunes;
- El análisis histopatológico, clasificado de acuerdo con MARSH o más recientemente la clasificación simplificada de Corazza, es el estándar de oro para el diagnóstico de la enfermedad.
Comparación entre las clasificaciones de Marsh y Corazza
| Marsh | LIE Marsh/Corazza |
Criptas | Vellosidades | Corazza |
|---|---|---|---|---|
| Tipo 0 | <40 | Normal | Normal | |
| Tipo 1 | >40/>25 | Normal | Normal | Grado A |
| Tipo 2 | >40/>25 | Hiperplásica | Normal | Grado A |
| Tipo 3 a/b | >40/>25 | Hiperplásica | Atrofia parcial o subtotal | Grado B1 |
| Tipo 3 c | >40/>25 | Hiperplásica | Atrofia total | Grado B2 |
| Tipo 4 | <40 | Normal | Atrofia total |
Adaptada de:
American College of Gastroenterology Guidelines Update 2023
Diagnóstico
El diagnóstico se realiza cuando hay serología positiva con histopatológico de las biopsias duodenales mostrando aumento de los linfocitos intraepiteliales con hiperplasia de criptas (Marsh 2) o, más comúnmente, con atrofia vellositaria (Marsh 3). Si la serología es positiva y las biopsias duodenales clasificadas como Marsh 0 o 1, prestar atención a anticuerpos falso-positivos (normalmente en baja titulación) o resultados falso-negativos en las biopsias, debiendo proseguir la investigación.
Diagnóstico sin biopsias
- En niños, la combinación de altos niveles de anti-tTG (> 10x LSN) y anti-endomisio positivo (en una segunda muestra) puede ser considerado para diagnóstico. En adultos sintomáticos que no pueden o no quieren ser sometidos a EDA, este criterio puede ser utilizado para el diagnóstico de EC probable;
- En pacientes con dermatitis herpetiforme comprobada por biopsias, el diagnóstico de EC puede ser establecido solo por la serología.
Pruebas HLA DQ2/DQ8
- Presente en casi todos los pacientes con EC, no es necesario para el diagnóstico, sin embargo es útil para excluirlo por su alto valor predictivo negativo (mayor que 99%);
- En pacientes con serología e histología divergentes:
- Si HLA DQ2/DQ8 negativo, EC es descartada;
- Si HLA DQ2/DQ8 positivo, serología positiva e histología no compatible: nuevas biopsias deben ser realizadas tras dieta con alto contenido de gluten (> 10 gramos/día, equivalente a 4 rebanadas de pan/día por 6 a 12 semanas). Tras nueva evaluación histológica, si Marsh 0 o 1 con serología positiva, el paciente es considerado con portador de EC potencial;
- Si HLA DQ2/DQ8 positivo, serología negativa, pero paciente con signos y síntomas sugestivos de EC e histología compatible: si se descartan otros diagnósticos diferenciales y hay mejora clínica e histológica tras dieta sin gluten, considerar EC seronegativa (es muy rara).
Referencias
- Rubio-Tapia, Alberto MD1; Hill, Ivor D. MD2; Semrad, Carol MD3; Kelly, Ciarán P. MD4; Greer, Katarina B. MD, MS5; Limketkai, Berkeley N. MD, PhD, FACG6; Lebwohl, Benjamin MD, MS7. American College of Gastroenterology Guidelines Update: Diagnosis and Management of Celiac Disease. The American Journal of Gastroenterology 118(1):p 59-76, January 2023. | DOI: 10.14309/ajg.0000000000002075
- Husby, Steffen et al. AGA Clinical Practice Update on Diagnosis and Monitoring of Celiac Disease—Changing Utility of Serology and Histologic Measures: Expert Review. Gastroenterology, Volume 156, Issue 4, 885 – 889 | DOI: 10.1053/j.gastro.2018.12.010
- Ciarán P. Kelly. Diagnosis of Celiac disease in adults. In: J Thomas Lamont (Ed). Up to date. 2024
Cómo citar este artículo
Arraes L, Penaloza C. ¿Cómo Diagnosticar Correctamente la Enfermedad Celíaca? Gastropedia 2024, vol 1. Disponible en:
https://gastropedia.pub/es/gastroenterologia/como-diagnosticar-corretamente-a-doenca-celiaca




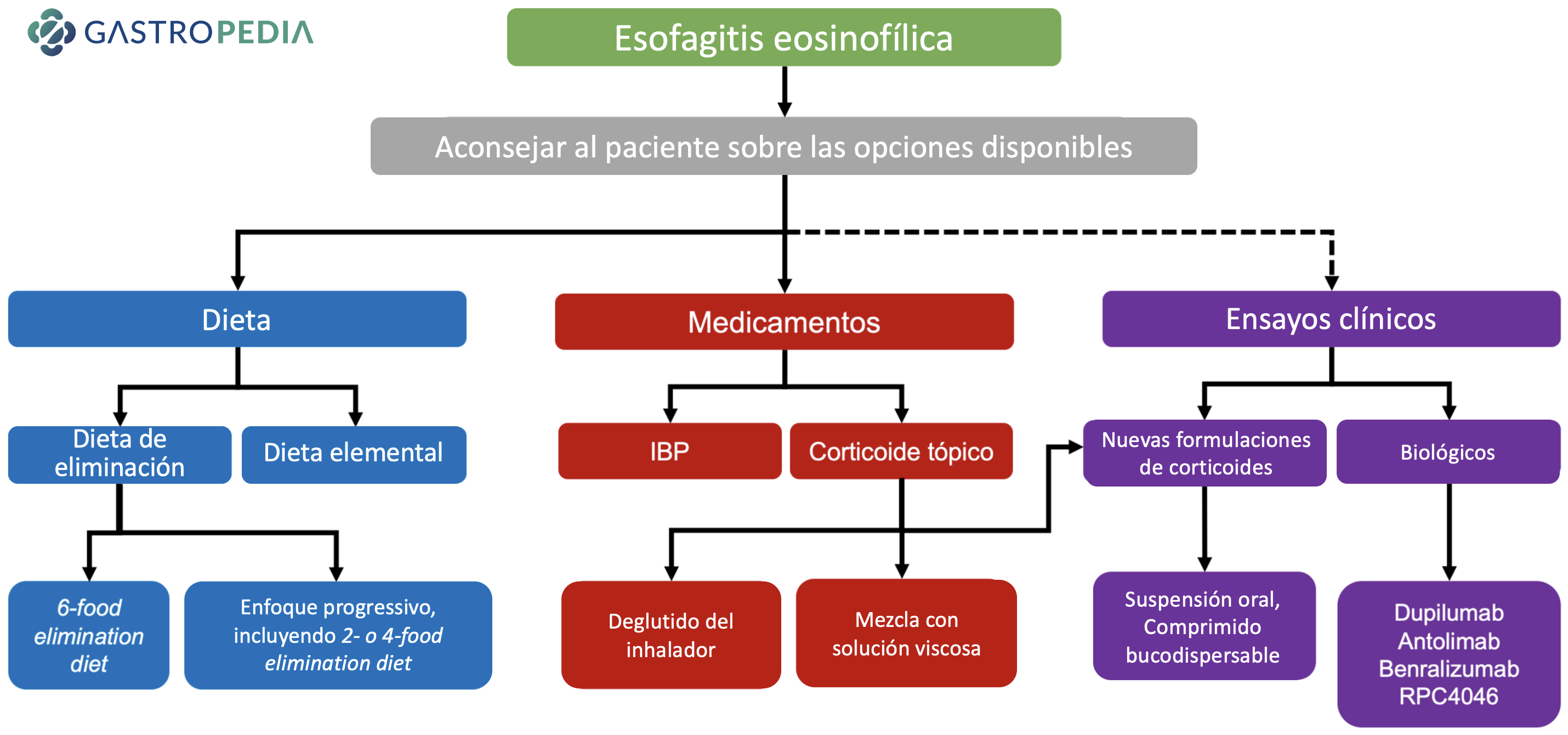 Figura 1: Diagrama de flujo de opciones para el tratamiento de la esofagitis eosinofílica. En el contexto apropiado, también puede ser necesaria la dilatación endoscópica. Adaptado de Beveridge & Falk (2020)[1]
Figura 1: Diagrama de flujo de opciones para el tratamiento de la esofagitis eosinofílica. En el contexto apropiado, también puede ser necesaria la dilatación endoscópica. Adaptado de Beveridge & Falk (2020)[1]