FIRE: Uma Síndrome Emergente Associada à Esofagite Eosinofílica
A esofagite eosinofílica (EoE) é uma condição esofágica crônica, de origem imunológica, associada à inflamação do tipo 2 e caracterizada por eosinofilia esofágica. Frequentemente, está associada a outras condições atópicas do tipo 2, como dermatite atópica, alergia alimentar mediada por IgE e rinite alérgica.
A EoE é caracterizada por sintomas de disfunção motora esofágica associados à infiltração eosinofílica da mucosa esofágica em resposta a alérgenos alimentares e/ou ambientais. O diagnóstico consiste na contagem de mais de 15 eosinófilos por campo de grande aumento em biópsias esofágicas, após a exclusão de outras causas comuns de eosinofilia esofágica.
E o que é a síndrome FIRE?
A Síndrome FIRE (Food-Induced Immediate Response of the Esophagus), por sua vez, é uma nova entidade clínica observada em pacientes com esofagite eosinofílica (EoE), caracterizada por uma resposta de hipersensibilidade imediata após o consumo de certos alimentos ou bebidas, com sintomas agudos e reprodutíveis.
Fisiopatologia
Embora ainda não completamente elucidada, discute-se algumas possibilidade, tais como:
- Hipersensibilidade local mediada por IgE.
- Ativação de mastócitos na mucosa e camada muscular esofágica.
- Barreira epitelial comprometida facilitando a entrada de alérgenos.
- Interação neuroimune (via canais TRPV1/ASICs) gerando hipersensibilidade sensorial.
Características clínicas
- Sintomas principais: dor retroesternal, sensação de aperto, queimação, sufocamento ou ansiedade logo após a ingestão dos alimentos.
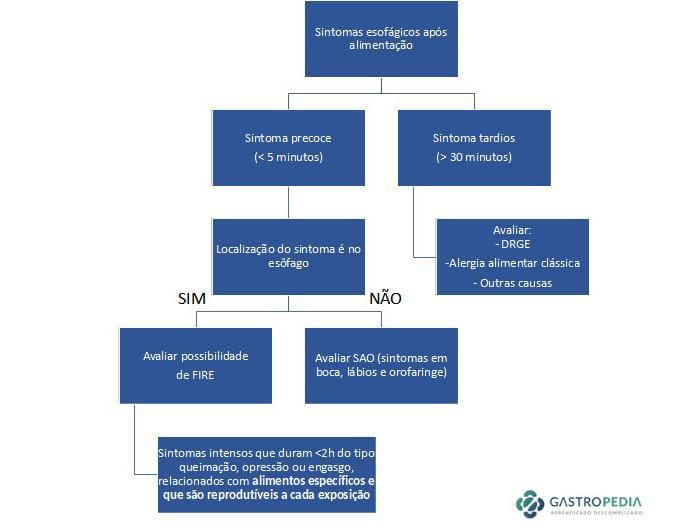
- Início: geralmente ocorre em até 5 minutos após o contato com o gatilho.
- Duração: entre minutos até 2 horas; na maioria, menos de 30 minutos.
- Intensidade: elevada (≥7 em escala analógica visual).
- Gatilhos comuns: frutas, vegetais, laticínios, vinho, cerveja, vinagre.
Curiosamente, os principais alimentos gatilho não coincidem com alguns dos principais desencadeadores da EoE (trigo, ovo e soja), o que sugere que os mecanismos de FIRE podem ser distintos – ou até sobrepostos – aos da inflamação eosinofílica tradicional.
FIRE é diferente da disfagia clássica da EoE e da síndrome da alergia oral
Embora alguns sintomas possam lembrar a síndrome de alergia oral (SAO), o FIRE é distinto: a reação se localiza no esôfago e não na orofaringe. Além disso, os pacientes reconhecem claramente a diferença entre FIRE e episódios de disfagia ou impactação alimentar comuns na EoE.
| Característica | FIRE | EoE clássica | SAO |
|---|---|---|---|
| Início após alimentação | Imediato (<5min) | Variável (disfagia tardia) | Imediato (<5min) |
| Duração dos sintomas | Minutos até 2h | Prolongado, crônico | Minutos |
| Localização | Esofágica (retroesternal) | Esofágica | Orofaringe (lábios, língua e palato) |
| Sintomas principais | Queimação, estreitamento, engasgo, ansiedade | Disfagia, impactação | Prurido oral, formigamento |
| Desencadeantes comuns | Frutas, vinho, laticínios e nozes | Leite, trigo, ovo e soja | Frutas e vegetais frescos |
| Associação com atopias | Frequente | Frequente | Muito frequente |
| Endoscopia e biópsia | Pode ser normal | Eosinofilia esofágica (>15 eos/CGA) | Normal |
Epidemiologia e diagnóstico
- Até 40% dos pacientes com EoE podem apresentar quadros sugestivos de síndrome FIRE
- FIRE pode preceder ou ocorrer independentemente da atividade da EoE.
- Ainda não há critérios diagnósticos padronizados; o diagnóstico é clínico e baseado na reprodutibilidade dos sintomas.
Conclusão
A síndrome FIRE representa uma nova dimensão dos sintomas esofágicos em pacientes com EoE, exigindo atenção especial dos profissionais de saúde, especialmente gastroenterologistas, alergistas e nutricionistas. Compreender esse fenômeno pode melhorar o cuidado clínico, otimizar estratégias de eliminação alimentar e, quem sabe, lançar luz sobre os mecanismos imunes da EoE.
Mais estudos são necessários para estabelecer critérios diagnósticos, entender sua fisiopatologia e desenvolver tratamentos eficazes.
Referências
- Koken G, Ertoy Karagol H, Polat Terece S, et al. Food-induced immediate response of the esophagus (FIRE) in pediatric eosinophilic esophagitis. Authorea. 2023 Jun 8. doi:10.22541/au.168620695.51164151/v1.
- Ali S, Cernat MC, Vintilă MR, Berghea EC, Bumbăcea RS. Shedding Light on FIRE Syndrome: An Overview of a Novel Condition in Eosinophilic Esophagitis. Applied Sciences. 2025; 15(11):6375. https://doi.org/10.3390/app15116375
- Biedermann L, Holbreich M, Atkins D, Chehade M, Dellon ES, Furuta GT, Hirano I, Gonsalves N, Greuter T, Gupta S, Katzka DA, De Rooij W, Safroneeva E, Schoepfer A, Schreiner P, Simon D, Simon HU, Warners M, Bredenoord AJ, Straumann A. Food-induced immediate response of the esophagus-A newly identified syndrome in patients with eosinophilic esophagitis. Allergy. 2021 Jan;76(1):339-347. doi: 10.1111/all.14495.
Como citar este artigo
Nobre K. FIRE: Uma Síndrome Emergente Associada à Esofagite Eosinofílica Gastropedia 2025, Vol II. Disponível em: https://gastropedia.pub/pt/gastroenterologia/fire-uma-sindrome-emergente-associada-a-esofagite-eosinofilica/