O Impacto do Teste Respiratório de Hidrogênio e Metano no Diagnóstico e Tratamento do Supercrescimento Bacteriano do Intestino Delgado (SIBO) e do Supercrescimento Metanogênico Intestinal (IMO)
O Supercrescimento Bacteriano do Intestino Delgado (SIBO, do inglês Small Intestinal Bacterial Overgrowth) é uma condição caracterizada pelo aumento excessivo de bactérias no intestino delgado, levando a sintomas como distensão abdominal, dor, excesso de gases, diarreia e até má absorção de nutrientes.
O Supercrescimento Metanogênico Intestinal (IMO), por sua vez, é uma condição em que há um aumento anormal de arqueias produtoras de metano no intestino. O diagnóstico preciso e o tratamento adequado são essenciais para o manejo dessas condições, sendo que os testes respiratórios têm se mostrado uma ferramenta valiosa nos últimos anos.
Tradicionalmente, o padrão-ouro para o diagnóstico do SIBO é o aspirado do fluido duodenal, um exame invasivo, de alto custo e de difícil acesso. A introdução do teste respiratório, que mede os gases exalados — como hidrogênio e metano — após a ingestão de carboidratos fermentáveis, proporcionou uma abordagem mais acessível, prática e menos invasiva. Atualmente, esse é o método mais recomendado para o diagnóstico tanto do SIBO quanto do IMO.
Este teste vem sendo constantemente aprimorado, e este artigo aborda as atualizações no diagnóstico e no tratamento do SIBO e do IMO com base nos testes respiratórios, especialmente na avaliação conjunta de hidrogênio e metano, em comparação com os testes que analisam apenas o hidrogênio exalado.
1. Teste Respiratório de Hidrogênio e Metano: Um Avanço no Diagnóstico
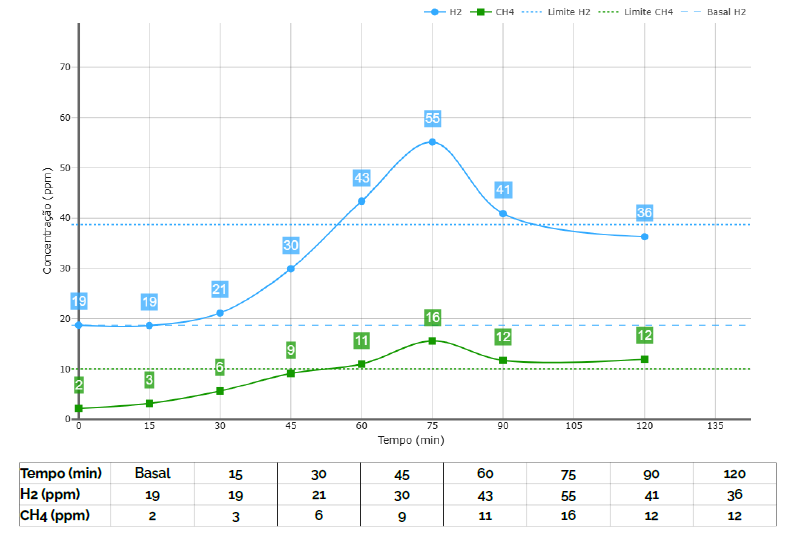
O teste respiratório de hidrogênio e metano avalia os gases exalados após a ingestão de uma solução contendo carboidratos, como lactulose ou glicose. No intestino delgado, a fermentação desses substratos por bactérias leva à produção de hidrogênio, enquanto a fermentação realizada por arqueias resulta na liberação de metano. Esses gases são absorvidos pela corrente sanguínea e eliminados pelos pulmões, podendo então ser medidos no ar expirado. Trata-se de um exame não invasivo, útil na detecção de SIBO e/ou IMO, especialmente quando combinado com um histórico clínico adequado.
Nos últimos anos, o teste respiratório de hidrogênio e metano tem sido cada vez mais valorizado pela sua capacidade de distinguir e diagnosticar o supercrescimento bacteriano do intestino delgado (SIBO) do supercrescimento metanogênico intestinal (IMO), dependendo do tipo de gás predominante exalado: hidrogênio e/ou metano.
Os pacientes com supercrescimento metanogênico podem apresentar sintomas semelhantes aos pacientes com supercrescimento bacteriano do intestino delgado, como distensão abdominal, flatulência excessiva, dor abdominal ou sensação de plenitude. No entanto, pacientes com IMO apresentam constipação predominante em vez de diarreia, devido ao gás metano causar retardo no trânsito intestinal. Isso implica que o tratamento para esses pacientes pode ser significativamente diferente, envolvendo diferentes estratégias de antibióticos e abordagens dietéticas. As arqueias são resistentes à maioria dos antibióticos. Em um estudo retrospectivo desenvolvido por Low e colaboradores, evidenciou-se que 85% dos pacientes tratados com rifaximina e neomicina apresentaram melhora clínica, comparado a 56% dos pacientes que receberam apenas rifaximina.
| CARACTERÍSTICA | SIBO (Hidrogênio) | IMO (Metano) |
|---|---|---|
| Causa | Excesso de bactérias no intestino delgado | Supercrescimento de arqueias |
| Diagnóstico | Aspirado duodenal, Teste respiratório de hidrogênio ou de hidrogênio e metano | Teste respiratório de hidrogênio e metano |
| Resposta ao tratamento com antibióticos | Boa resposta a rifaximina, amoxicilina-clavulanato, metronidazol ou ciprofloxacina | Melhor resposta a terapia combinada com rifaximina e neomicina |
| Sintomas predominantes | Distensão abdominal, gases, diarreia | Distensão abdominal, flatulência excessiva, constipação |
2. Fatores de Risco e Predisposição para SIBO e IMO
Diversos fatores podem predispor indivíduos ao desenvolvimento de SIBO e IMO. A identificação e o tratamento dessas condições, quando possível, melhoram significativamente a qualidade de vida dos pacientes e diminuem o risco de recorrência dos sintomas.
| Características fisiopatológicas | Doenças e condições associadas |
|---|---|
| Motilidade Intestinal Anormal | Neuropatia autonômica diabética, gastroparesia, miotomia, esclerodermia, síndrome do intestino irritável |
| Anormalidades Anatômicas | Cirurgias com alças intestinais cegas (gastrectomia, cirurgia bariátrica), diverticulose, fístulas, entre outras |
| Hipocloridria | Uso prolongado de inibidores de ácido, gastrite atrófica |
| Imunodeficiência | Imunodeficiências hereditárias e adquiridas |
| Multifatorial | Doença celíaca, doença inflamatória intestinal, pancreatite crônica, idade avançada, endometriose |
3. Teste Respiratório de Hidrogênio e Metano: Limitações
A principal limitação dos testes respiratórios é o fato de serem influenciados por vários fatores, como a motilidade intestinal, a elevada taxa de absorção de carboidratos ou o uso prévio de antibióticos e outros medicamentos como laxantes, o que pode levar a resultados falso-negativos ou falso-positivos.
O substrato utilizado nos testes como lactulose ou glicose, pode chegar ao cólon intacto, onde é fermentado por bactérias colônicas, resultando na produção de hidrogênio. Isso pode levar a um aumento nos níveis desses gases precocemente no ar exalado quando o paciente apresenta alta motilidade intestinal, mesmo sem supercrescimento bacteriano no intestino delgado, resultando em um falso-positivo. Portanto, as orientações antes do exame, a suspensão de alguns medicamentos e a adequada avaliação da curva dos gráficos associados à clínica do paciente são essenciais para um diagnóstico adequado.
4. Avanços no Tratamento com Base no Novo Diagnóstico
Com a introdução do teste respiratório de hidrogênio e metano, o tratamento do SIBO e IMO tornou-se mais personalizado. Diferentemente dos testes que avaliam apenas o hidrogênio exalado, a inclusão da análise de metano permite uma melhor caracterização dos perfis microbianos presentes no intestino delgado.
Essa distinção é especialmente relevante para a escolha do tratamento antibiótico, uma vez que a resposta terapêutica pode variar conforme o tipo de gás predominante produzido pelas bactérias. Pacientes com supercrescimento de espécies metanogênicas (produtoras de metano) tendem a responder melhor a esquemas combinados, como rifaximina associada à neomicina, que demonstraram maior eficácia do que a monoterapia nesses casos.
A escolha do antibiótico para o tratamento de SIBO pode incluir opções como rifaximina, amoxicilina-clavulanato, metronidazol, ciprofloxacina e/ou neomicina, dependendo do perfil de produção gasosa e dos sintomas clínicos. Assim, o teste respiratório com avaliação de hidrogênio e metano não apenas aprimora o diagnóstico, como também permite um tratamento mais direcionado e eficaz.
Além disso, os testes respiratórios também oferecem insights mais precisos sobre a resposta a dietas específicas, como a dieta low FODMAP, que pode ser ajustada conforme os tipos de carboidratos que mais afetam cada paciente. Isso torna o tratamento mais direcionado e pode melhorar a eficácia do manejo dietético.
5. Conclusão
Com o avanço no uso do teste respiratório de hidrogênio e metano e a capacidade de identificar diferentes perfis bacterianos no intestino delgado, como a distinção entre SIBO e IMO, busca-se um tratamento mais preciso e personalizado, abordando as causas subjacentes de maneira mais eficaz. Embora o teste de hidrogênio exalado ainda seja útil, a inclusão do metano fornece uma visão mais completa, ajudando a otimizar tanto o diagnóstico quanto as estratégias terapêuticas para o manejo do SIBO e IMO.
Referências
- Rezaie A, Buresi M, Lembo A, Lin H, McCallum R, Rao S, et al. Hydrogen and methane-based breath testing: The North American Consensus. Am J Gastroenterol. 2017 Mar 21. doi:10.1038/ajg.2017.46.
- Hammer HF, Fox MR, Keller J, Salvatore S, Basilisco G, Hammer J, et al. European H2-CH4-breath test group. United European Gastroenterol J. 2022 Feb;10(1):15-40. doi:10.1002/ueg2.12133.
- Silva BC, Ramos GP, Barros LL, Ramos AFP, Domingues G, Chinzon D, Passos MCF. Diagnosis and treatment of small intestinal bacterial overgrowth: An official position paper from the Brazilian Federation of Gastroenterology. Arq. Gastroenterol. 62 • 2025 • https://doi.org/10.1590/S0004-2803.24612024-107
Como citar este artigo
Sampaio CT. O Impacto do Teste Respiratório de Hidrogênio e Metano no Diagnóstico e Tratamento do Supercrescimento Bacteriano do Intestino Delgado (SIBO) e do Supercrescimento Metanogênico Intestinal (IMO). Gastropedia 2025, Vol II. Disponível em: https://gastropedia.pub/pt/gastroenterologia/o-impacto-do-teste-respiratorio-de-hidrogenio-e-metano-no-diagnostico-e-tratamento-do-supercrescimento-bacteriano-do-intestino-delgado-sibo-e-do-supercrescimento-metanogenico-intestinal-imo/