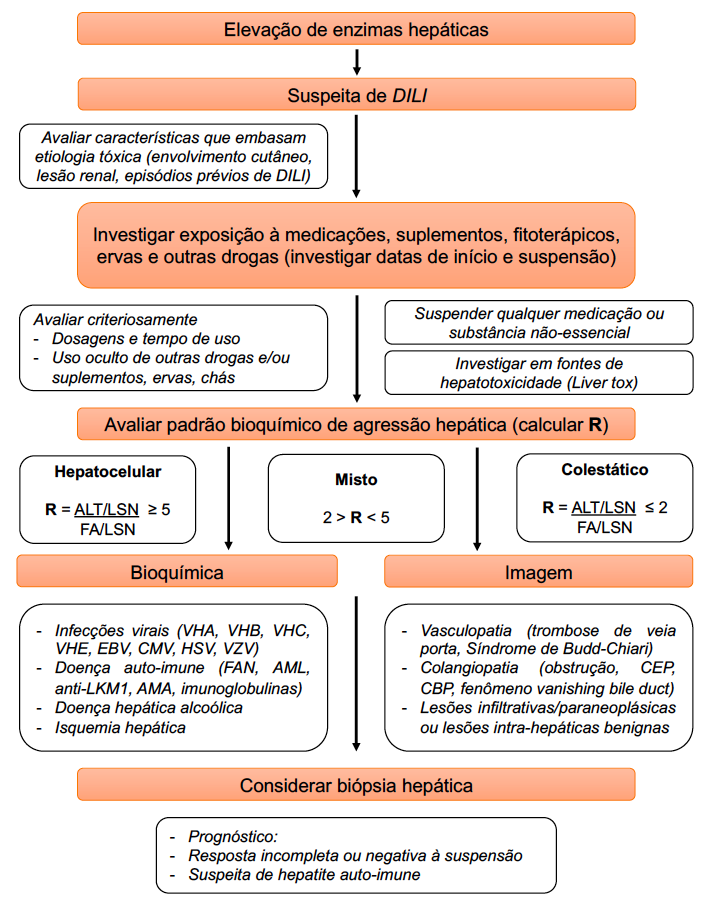
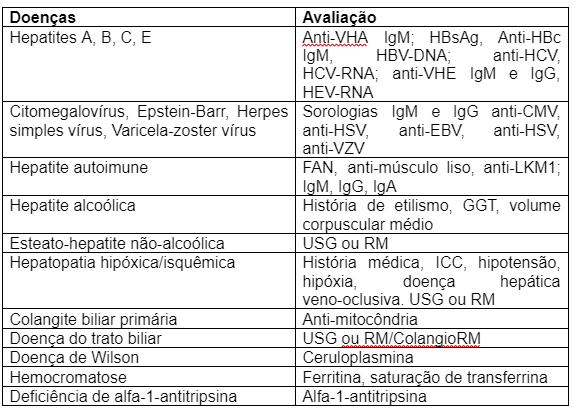
NAFLD agora é MASLD: entenda a nova nomenclatura
A doença hepática gordurosa não alcoólica (DHGNA; nonalcoholic fatty liver disease, NAFLD) foi assim nomeada em 1980 a fim de descrever pacientes com hepatopatia crônica sem consumo de álcool significativo. Apesar de amplamente utilizada, o avanço do entendimento a respeito da fisiopatologia da doença nas últimas décadas tornou evidente a falha em sua nomenclatura ao utilizar o termo “não alcoólica”, não captando com precisão a verdadeira etiologia da doença e se baseando em diagnóstico de exclusão. Além disso, o termo “gordurosa” era considerado estigmatizante por alguns.
Em 2020, um artigo de Eslam e colaboradores trouxe a proposta de usar o termo doença hepática gordurosa metabólica (DHGM/MAFLD) para definir pacientes com esteatose hepática e fatores de risco metabólicos, independentemente da quantidade e do padrão de ingestão de álcool. Embora o termo MAFLD tenha sido aceito por alguns, implicava não somente na mudança da nomenclatura, mas também da definição da doença, incluindo pacientes com consumo etílico significativo sob a mesma definição e mantendo o termo “gordurosa”. Além disso, pacientes com índice de massa corporal normal, classificados com “lean NAFLD”, poderiam não preencher critérios para MAFLD. Todos esses aspectos apresentavam potencial impacto negativo em termos de aplicação dos dados de pesquisa pré-existentes, entendimento da história natural da doença, biomarcadores e desenvolvimento terapêutico.
Considerando todas estas questões, um esforço conjunto das principais sociedades de hepatologia ao redor do mundo, dentre elas Asociación Latinoamericana para el Estudio del Hígado (ALEH), American Association for the Study of Liver Diseases (AASLD) e European Association for the Study of the Liver (EASL), levou ao desenvolvimento da nova nomenclatura da DHGNA/NAFLD, anunciada em junho deste ano. O detalhamento completo do processo que levou à nova nomenclatura, através do método Delphi modificado, foi publicado nas principais revistas de hepatologia do mundo, sendo elas Hepatology, Annals of hepatology e Journal of Hepatology. Recentemente, em comunicado da ALEH, a versão adaptada para o português da respectiva nomenclatura foi disponibilizada, e será adotada neste artigo.
Foram realizados 4 encontros online e 2 encontros híbridos, envolvendo 236 painelistas de 56 países, dentre eles hepatologistas, gastroenterologistas, pediatras, endocrinologistas, patologistas, especialistas em obesidade, representantes da indústria, agências regulatórias e organizações de pacientes. O comitê diretivo do painel Delphi foi liderado por um representante da AASLD e outro da EASL, e composto por outros 34 membros nomeados por suas respectivas associações a fim de garantir representatividade geográfica. As mudanças adotadas foram baseadas em consenso de uma maioria igual ou superior a 67% dos participantes para cada questão abordada, embora apenas 66% dos participantes considerassem estigmatizante o termo “gordurosa” na nomenclatura anterior.
Durante o processo, a maioria dos painelistas consideravam a nomenclatura anterior falha e desejavam uma nova nomenclatura que descrevesse a real etiologia da doença,contendo em seu descritor o termo “doença ou disfunção metabólica”, levando a um maior entendimento por parte dos pacientes a respeito da própria patologia. Tanto o termo abrangente esteatose hepática (EH; Steatotic liver disease,SLD) quanto o termo mais específico, esteatose hepática metabólica (EHM; metabolic dysfunction-associated steatotic liver disease, MASLD), fornecem uma descrição afirmativa e não estigmatizante da condição, ao invés de um diagnóstico de exclusão.
Conheça as principais mudanças da nova nomenclatura:
- Esteatose hepática (EH; Steatotic liver disease, SLD) foi escolhido como termo abrangente, englobando as mais diversas etiologias de esteatose hepática (Figura 1).

Disponível em: https://alehlatam.org/wp-content/uploads/2023/08/Nueva-Nomenclatura-SLD-ALEH-Dra.-Graciela-Castro-2023-POR.pdf
- O termo esteato-hepatite foi considerado conceito fisiopatológico importante, sendo mantido.
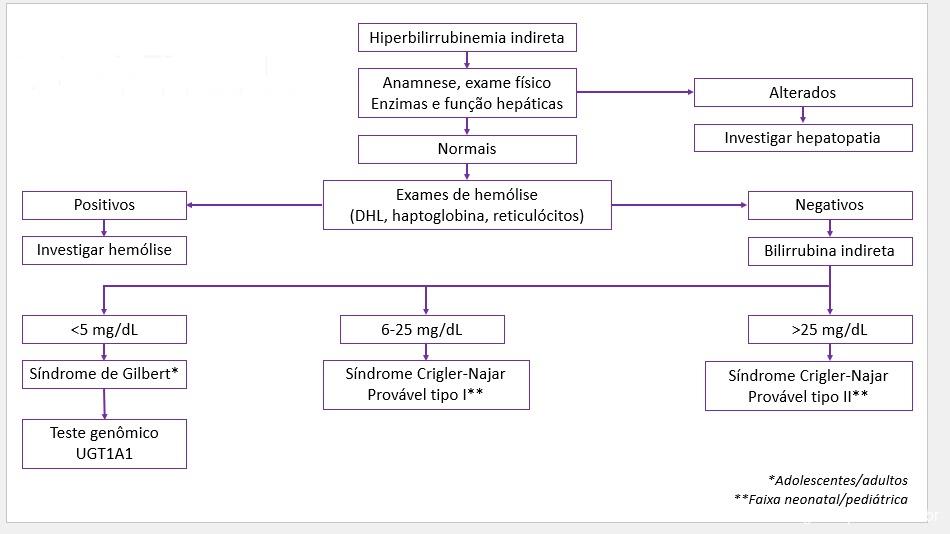
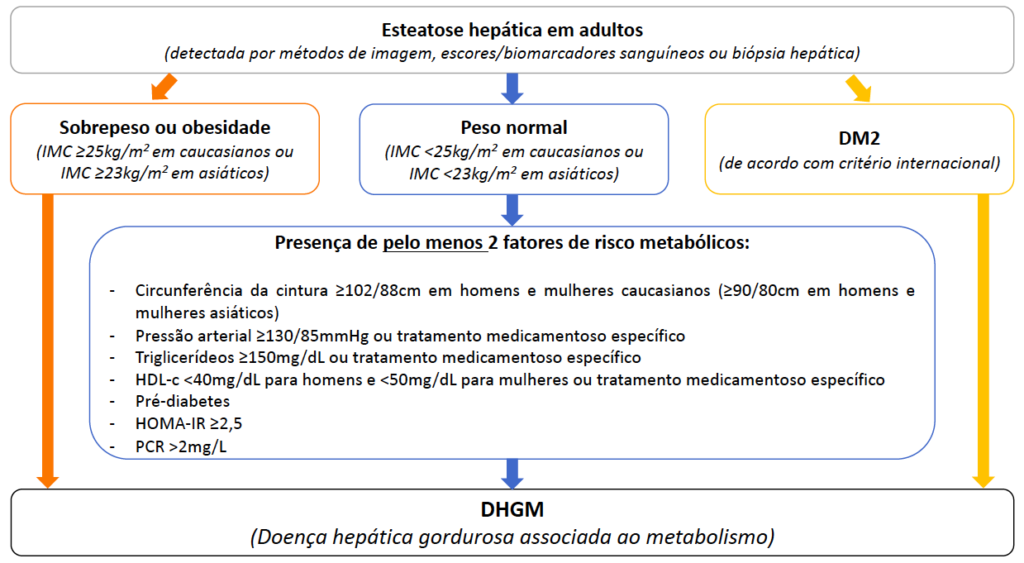
- A Doença Hepática Gordurosa Não Alcoólica (DHGNA/NAFLD) associada à disfunção metabólica passou a ser nomeada esteatose hepática metabólica (EHM; metabolic dysfunction-associated steatotic liver disease, MASLD), incluindo pacientes com esteatose hepática e pelo menos um dos cinco fatores de risco cardiometabólicos (figura 2). É importante salientar que o diagnóstico de EHM não exclui outras possíveis etiologias associadas.
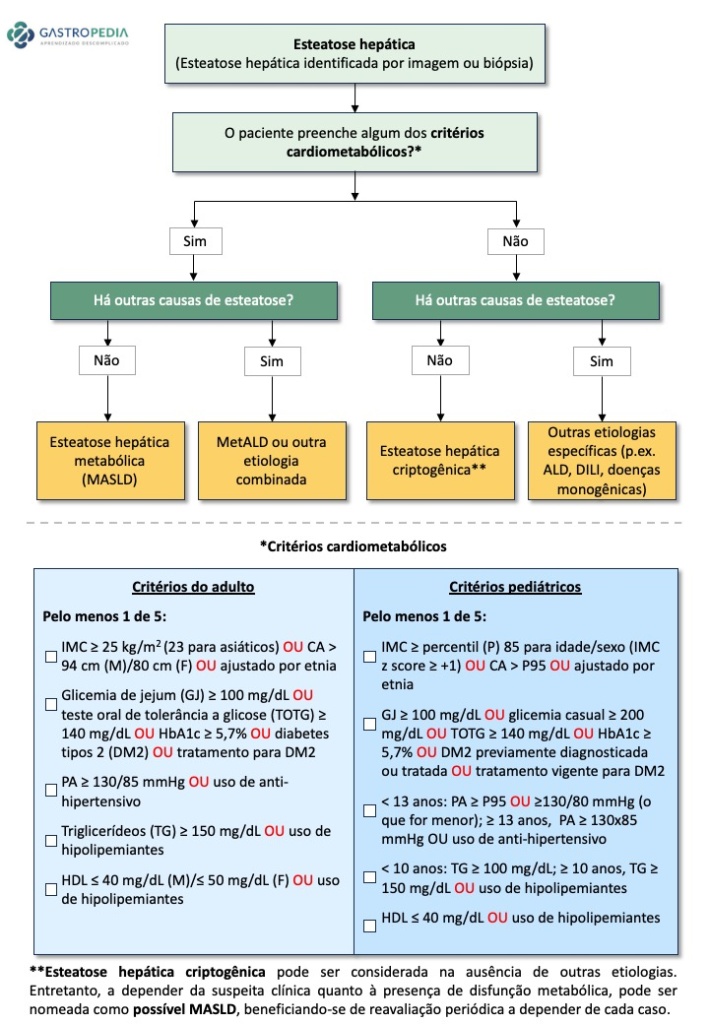
- Um dos maiores destaques da nova nomenclatura, a criação de uma nova categoria denominada Esteatose Hepática Metabólica por disfunção metabólica e álcool (MetALD), foi utilizada para descrever aqueles com MASLD que consomem quantidades semanais de álcool maiores do que aquelas estabelecidas como limite superior de consumo na definição de MASLD pura mas ainda não se enquadram em doença hepática alcoólica (140-350 g/semana para mulheres e 210-420 g/semana para homens).
- Dentro da categoria MetALD há um espectro dinâmico onde a condição pode apresentar predominância do componente alcoólico ou metabólico. O fator predominante pode variar ao longo da vida de um mesmo indivíduo.
- “MASLD com esteato-hepatite” ou esteato-hepatite metabólica/Metabolic dysfunction-associated steatohepatitis (MASH) é o termo que substitui a esteato-hepatite não alcoólica (NASH).
- O termo esteatose hepática também abrange doença hepática associada ao consumo excessivo de álcool (ALD) (>70 g/dia) e outras hepatopatias de etiologia específica como infecção pelo vírus da hepatite C, causas genéticas, dentre outras.
- Esteatose hepática criptogênica é o termo utilizado para definircasos que não apresentam fatores de risco cardiometabólicos ou causa conhecida para a esteatose hepática.
- Possível MASLD é o termo que pode ser considerado na definição de casos com forte suspeita clínica de disfunção metabólica, na ausência dos fatores de risco cardiometabólicos, até a obtenção de testes adicionais como HOMA-IR e teste oral de tolerância a glicose.
Podemos extrapolar dados de pesquisa prévia em NAFLD para MASLD?
À semelhança de MAFLD, a nova nomenclatura MASLD também implica em mudança de definição da doença, levantando novamente questões quanto à preservação dos dados de pesquisa pré-existentes e ao impacto na validação de biomarcadores para diagnóstico e no desenvolvimento de novas terapias. Análise de dados do consórcio europeu LITMUS demonstrou que 98% dos pacientes registrados com NAFLD preencheriam critérios de MASLD. Da mesma maneira, estudo de Song e colaboradores demonstrou que, dentre 261 pacientes com diagnóstico de DHGNA por espectroscopia por ressonância magnética, apenas 6 (2,3%) não preenchiam critérios para MASLD, enquanto 14 (5,4%) não preenchiam critérios para MAFLD. Conceitualmente, pacientes que antes se enquadravam na definição de NAFLD poderão ser categorizados em MASLD ou possível MASLD. A introdução da subcategoria MetALD traz a oportunidade de gerar novo conhecimento a respeito deste grupo comum de pacientes.
Conheça nosso curso Gastroenterologia do Consultório e saiba como lidar com as queixas mais comuns que encontramos no dia a dia
Referências
- Rinella ME, Lazarus JV, Ratziu V, Francque SM, Sanyal AJ, Kanwal F, Romero D, Abdelmalek MF, Anstee QM, Arab JP, Arrese M, Bataller R, Beuers U, Boursier J, Bugianesi E, Byrne C, Castro Narro GE, Chowdhury A, Cortez-Pinto H, Cryer D, Cusi K, El-Kassas M, Klein S, Eskridge W, Fan J, Gawrieh S, Guy CD, Harrison SA, Kim SU, Koot B, Korenjak M, Kowdley K, Lacaille F, Loomba R, Mitchell-Thain R, Morgan TR, Powell E, Roden M, Romero-Gómez M, Silva M, Singh SP, Sookoian SC, Spearman CW, Tiniakos D, Valenti L, Vos MB, Wong VW, Xanthakos S, Yilmaz Y, Younossi Z, Hobbs A, Villota-Rivas M, Newsome PN; NAFLD Nomenclature consensus group. A multi-society Delphi consensus statement on new fatty liver disease nomenclature. Hepatology. 2023 Jun 24. doi: 10.1097/HEP.0000000000000520. Epub ahead of print. PMID: 37363821.
- Nova nomenclatura esteatose hepática. ALEH, 2023. Disponível em: https://alehlatam.org/wp-content/uploads/2023/08/Nueva-Nomenclatura-SLD-ALEH-Dra.-Graciela-Castro-2023-POR.pdf
- Eslam M, Newsome PN, Sarin SK, Anstee QM, Targher G, Romero-Gomez M, Zelber-Sagi S, Wai-Sun Wong V, Dufour JF, Schattenberg JM, Kawaguchi T, Arrese M, Valenti L, Shiha G, Tiribelli C, Yki-Järvinen H, Fan JG, Grønbæk H, Yilmaz Y, Cortez-Pinto H, Oliveira CP, Bedossa P, Adams LA, Zheng MH, Fouad Y, Chan WK, Mendez-Sanchez N, Ahn SH, Castera L, Bugianesi E, Ratziu V, George J. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J Hepatol. 2020 Jul;73(1):202-209. doi: 10.1016/j.jhep.2020.03.039. Epub 2020 Apr 8. PMID: 32278004.
- Song SJ, Lai JC, Wong GL, Wong VW, Yip TC. Can we use old NAFLD data under the new MASLD definition? J Hepatol. 2023 Aug 2:S0168-8278(23)05000-6. doi: 10.1016/j.jhep.2023.07.021. Epub ahead of print. PMID: 37541393.
Como citar este artigo
Recuero AM. NAFLD agora é MASLD: entenda a nova nomenclatura Gastropedia 2023, vol. 2. Disponível em: gastropedia.pub/pt/gastroenterologia/figado/nafld-agora-e-masld-entenda-a-nova-nomenclatura/