Hipoglicemia pós bariátrica
A hipoglicemia hiperinsulinêmica ou reativa é uma complicação que pode ocorrer após a cirurgia bariátrica, principalmente após gastroplastia com bypass gástrico em Y de Roux (BGYR). Normalmente, ocorre após o 1º ano da cirurgia e quase exclusivamente no período pós-prandial, 1 a 3 horas após as refeições.
Estimativas sugerem que menos de 1% dos pacientes submetidos ao BGYR apresentam hipoglicemia com necessidade de hospitalização e cerca de 10% apresentam hipoglicemia clinicamente reconhecida.
Fisiopatologia
A hipoglicemia reativa resulta de uma resposta hiperinsulinêmica exagerada após a ingestão de carboidratos.
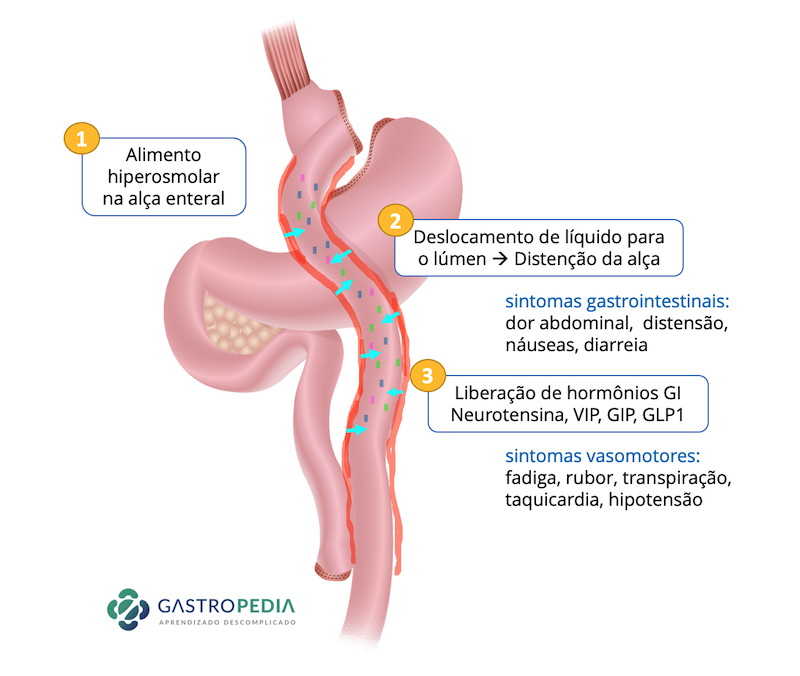
Uma das hipóteses é que a hipoglicemia pode estar relacionada ao aumento da sensibilidade à insulina mediada pela resposta exacerbada do peptídeo-1 semelhante ao glucagon (GLP-1) gerada pela cirurgia bariátrica.
Outra hipótese seria a de que alguns pacientes submetidos à cirurgia bariátrica tendem a ter um retardo na diminuição da produção de insulina pelas células beta pancreáticas, em resposta à redução da glicemia, ou mesmo apresentar uma diminuição no clearance de insulina, o que pode contribuir para elevações sustentadas de seus níveis plasmáticos, facilitando a hipoglicemia.
Geralmente, após a cirurgia RYGB, observa-se uma diminuição do glucagon pós-prandial. Essa redução na resposta hormonal contrarreguladora pode perpetuar a hipoglicemia.
Diagnóstico
Os critérios para definir o diagnóstico de hipoglicemia reativa devem atender à tríade de Whipple:
- Sintomas de hipoglicemia;
- Baixas concentrações de glicose plasmática (< 54 mg/dl);
- Alívio dos sintomas após a ingestão de carboidratos.
Os sintomas relacionados à hipoglicemia podem incluir: fadiga, fraqueza, confusão, fome, síncope, sudorese, palpitações, tremores e irritabilidade. A hipoglicemia pode ser grave e incapacitante para alguns pacientes, podendo levar a quedas e acidentes.
Uma glicemia capilar baixa deve ser sempre confirmada com uma medida de glicose plasmática. As concentrações de insulina nesses indivíduos não são totalmente suprimidas no momento da hipoglicemia.
Embora o monitoramento contínuo da glicose (CGM) seja menos preciso na faixa hipoglicêmica, ele pode ser útil para identificar padrões de excursões glicêmicas, mas não deve ser usado para fins diagnósticos.
O teste provocativo, nesse cenário, deve idealmente usar uma refeição mista contendo proteína, carboidratos e gordura. Não há nenhum padrão atualmente aceito para o teste de refeição. Tanto refeições mistas sólidas quanto líquidas têm sido usadas na prática clínica e em estudos de pesquisa, com conteúdo de carboidratos variando de 40 a 75 g. A indução de hipoglicemia apresenta o risco de hipoglicemia grave e deve ser feita em um ambiente seguro.
O jejum hospitalar prolongado é reservado para pacientes com hipoglicemia em jejum, indivíduos com hipoglicemia iniciando menos de 1 ano após a cirurgia bariátrica ou com outras características atípicas, para excluir o raro insulinoma em pacientes pós-bariátricos.
Outros testes diagnósticos adicionais podem ser considerados para descartar outras causas que podem coexistir no cenário pós-bariátrico, como insuficiência adrenal, doença crítica ou desnutrição associada à perda excessiva de peso.
Tratamento
O objetivo do tratamento na hipoglicemia pós-RYGB é reduzir a frequência e a gravidade da hipoglicemia. A dieta é a base do tratamento e tem como objetivo reduzir o estímulo para picos glicêmicos e secreção de insulina.
Um plano de refeições focado na eliminação de açúcares simples, mas incluindo porções controladas de carboidratos de baixo índice glicêmico em várias pequenas refeições ao longo do dia, costuma ser bem tolerado e eficaz em reduzir as hipoglicemias. A substituição de alguns carboidratos à base de glicose por frutose também pode reduzir as excursões glicêmicas. Também recomenda-se o consumo de carboidratos complexos junto com proteínas e gorduras saudáveis. Proteínas e gorduras podem retardar a absorção de nutrientes, reduzindo picos de glicose e subsequente hipoglicemia.
Recomendações adicionais incluem:
- Mastigar completamente os alimentos;
- Comer devagar;
- Evitar líquidos nas refeições para evitar sintomas de dumping;
- Evitar excesso de cafeína e álcool, que podem causar hipoglicemia por inibição da liberação hepática de glicose.
Quando se desenvolve hipoglicemia sintomática, recomenda-se a correção com 10 a 15 g de carboidratos orais. Em caso de neuroglicopenia grave com alteração ou perda de consciência, o glucagon pode ser administrado por um familiar.
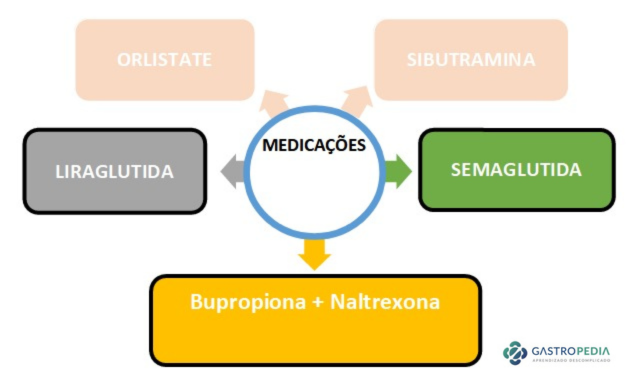
Tratamento Medicamentoso
- Acarbose: Retarda e reduz a absorção de glicose pela inibição da α-glicosidase intestinal, necessária para quebrar os carboidratos luminais em monossacarídeos. A introdução de doses baixas e o aumento gradativo até a dose máxima tolerada podem ser eficazes na limitação dos efeitos colaterais gastrointestinais.
- Diazóxido: Reduz a secreção de insulina por inibição de canais de potássio sensíveis ao ATP das células beta. Relatos de casos em hipoglicemia pós-bariátrica mostram eficácia, mas efeitos colaterais (retenção de líquidos, edema, náusea, hipotensão e cefaleia) podem limitar a adesão do paciente.
- Análogos da somatostatina: Podem reduzir a secreção de GLP-1 e insulina. Poucos estudos avaliaram sua eficácia em hipoglicemia reativa, mas há relatos de prevenção bem-sucedida da hipoglicemia com octreotida por 6 meses, seguida de lanreotida. Este tratamento é limitado pelo alto custo e efeitos colaterais (diarreia, esteatorreia, riscos de colelitíase e prolongamento do intervalo QT).
Relatos de casos ou pequenas séries sugerem eficácia de bloqueadores de canal de cálcio e agonistas do GLP-1.
Abordagem Cirúrgica
Em casos graves e refratários aos tratamentos tradicionais, podem ser consideradas:
- Pancreatectomia parcial;
- Reversão do BGYR;
- Colocação de banda ou anel;
- Plicatura endoscópica;
- Transformação do BGYR em sleeve gástrico (SG);
- Colocação de tubo de gastrostomia (tubo G) no estômago excluído.
Devido à alta morbidade, resolução incompleta ou recorrência dos sintomas, esses procedimentos devem ser realizados de forma criteriosa e individualizada.
Referências
- Salehi M, Vella A, McLaughlin T, Patti ME. Hypoglycemia after gastric bypass surgery: current concepts and controversies. J Clin Endocrinol Metab. 2018;103(8):2815-2826.
- Pereira SE, et al. Brazilian guide to nutrition in bariatric and metabolic surgery. Langenbecks Arch Surg. 2023;408(1):143.
Como citar este artigo
Azevedo CA. Hipoglicemia pós bariátrica Gastropedia 2025, Vol 1. Disponível em: https://gastropedia.pub/pt/cirurgia/hipoglicemia-pos-bariatrica/