Megacolon Chagasico: Diagnóstico e Tratamento
Diagnóstico e Investigação
Testes sorológicos: na fase crônica da doença deve-se utilizar pelo menos dois métodos de princípios diferentes para a confirmação do diagnóstico, com sensibilidade de 100% e especificidade de 96,5%. São eles: hemoaglutinação indireta, imunofluorescência indireta e teste imunoenzimático.
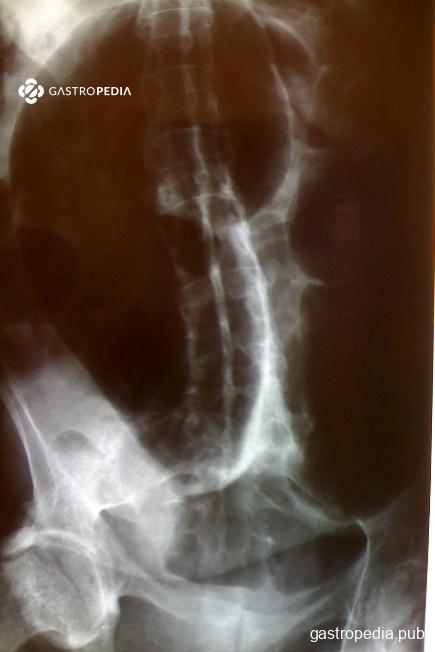
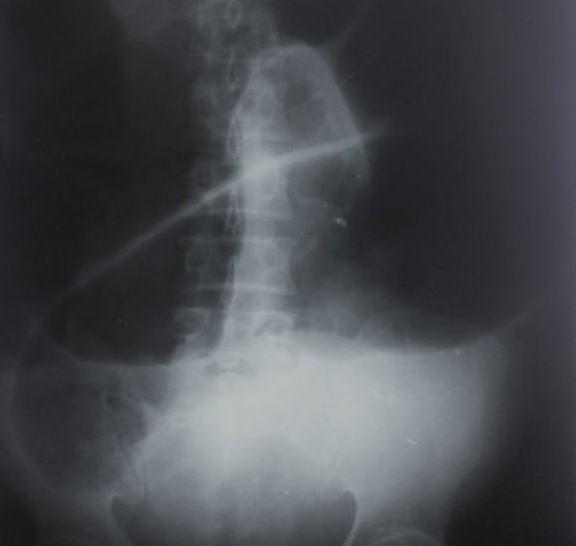
Exame contrastado: Considera-se que o diâmetro do sigmóide distal maior que 6 cm caracteriza megacólon. No entanto, através do enema opaco, grupo brasileiro, fez estudo com proposta de uma classificação do diâmetro transverso do reto alto/sigmóide distal na altura das cristas póstero-superiores ou ao nível da quarta vértebra lombar. Dessa forma, subdividiu em:
- Grau 0: pacientes sem MC: eixo transversal entre 2,0 e 5,0cm
- Grau I: intersecção entre pessoas com e sem MC. Eixo entre 5,1 e 9,0cm
- Grau II: eixo transverso entre 9,1 e 13,0cm
- Grau III: eixo maior que 13,1cm
Manometria anorretal: exame reprodutível e examinador dependente com avaliação dos esfíncteres interno e externo do ânus, relaxamento do músculo puborretal, sensibilidade e capacidade do reto e, na suspeita de MC. A ausência reflexo inibitório retoanal (RIRA), significando comprometimento da inervação da transição anorretal e acalasia do esfíncter interno do ânus, embora seu papel nessa doença ainda permaneça controverso.
Nesse aspecto, grupo brasileiro avaliou a presença do RIRA em 39 portadores de MC e verificou sua ocorrência em 43,6% dos pacientes, entretanto com necessidade de maior insuflação do balão retal com uma média de 196 ml, ao passo que em pessoas sem MC a média de infusão foi de 18,8 ml. Assim, ao injetar 30 ml de ar a probabilidade de detectar o RIRA foi de 12,8%, com 60ml de 15,4% e com 250ml de 43,6%.
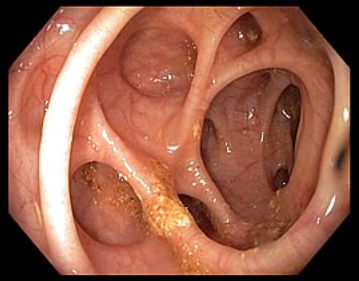
Colonoscopia: exame com objetivo fundamentalmente de rastreio de câncer colorretal, devendo sua indicação obedecer as diretrizes vigentes na literatura nacional e internacional quanto à idade e fatores de risco principalmente.
Tratamento
a) Clínico:
Inicia-se o tratamento do portador de MC sintomático para constipação intestinal com medidas clínica, como:
- Estimular ingesta hídrica: exceção aos pacientes cardiopatas com restrição de líquidos;
- Evitar dieta rica em fibras e formadores de bolo fecal pois aumentam a chance de impactação fecal;
- Uso de medicamentos laxativos: lactulose, polietilenoglicol, picossulfato de sódio. Em situações de não evacuação por tempo mais prolongado pode-se utilizar o bisacodil e o uso de supositórios de glicerina a cada 3 a 5 dias
- Fisioterapia do assoalho pélvico e biofeedback: para casos em que se associa dissinergia pélvica.
- Lavagem intestinal: naquelas situações de não evacuação por longo tempo, mais de 5 dias com as medidas acima, orienta-se a realização de enteroclisma, sempre antecedido de toque retal para a avaliação de fecalomas. Essa, inclusive, é uma das principais indicações de cirurgia eletiva em portadores de MC, ou seja, a refratariedade aos laxantes por via oral e necessidade frequente de idas ao pronto-socorro ou pronto-atendimento para a realização de lavagens intestinais.
b) Cirúrgico:
As indicações de cirurgia são: refratariedade do tratamento clínico com necessidade frequente de lavagens intestinais e as complicações agudas, como o volvo de sigmóide principalmente. A cirurgia, quando bem indicada, proporciona importante alívio e melhora do principal sintoma do MC que é a constipação intestinal de tal forma, que a frequência dessa queixa é de 76% entre os pacientes não operados e de 39% entre os pacientes submetidos ao tratamento cirúrgico (p<0,01). Além disso, estudos demonstram melhora significativa do escore de gravidade de constipação após a cirurgia.
Entretanto, é preciso ter em mente e, transparecer isso aos pacientes e familiares, que a cirurgia para o MC não cura a doença. Os principais objetivos são a melhora da constipação e a redução dos riscos de complicações, como o volvo de sigmoide e a impactação fecal com consequente formação de fecalomas.
Grande parte dos cirurgiões colorretais mais antigos tiveram seus relevantes aprendizados técnicos com a realização de procedimentos para o tratamento do MC, sendo que as principais abordagens para o tratamento dessa doença foram descritas por renomados profissionais do nosso país e as cirurgias possíveis compreendem uma infinidade de técnicas que envolvem diferentes extensões de ressecção do cólon, níveis e formas de anastomose, resultando em morbidade e recorrência pós-operatória variáveis. O racional do tratamento cirúrgico é ressecar toda a área de sigmóide dilatada (sigmoidectomia completa) e evitar a região da transição retossigmoideana para a realização das anastomoses, a fim de evitar a recidiva precoce dos sintomas.
Sendo assim, dentre as principais técnicas descritas historicamente, pode-se citar:
- Técnica de Swenson e Soave: abaixamento de cólon transretal com ressecção de mucosa retal e telescopagem, descrita no final dos anos 1940.
- Técnica de Duhamel-Haddad: abaixamento de cólon retro-retal posterior com exteriorização do coto e anastomose retardada, descrita entre os anos 1950 e 1960.
- Técnica de Duhamel-Haddad modificada: abaixamento de cólon retro-retal posterior com tentativa de anastomose primária e utilização de pinças esmagadoras.
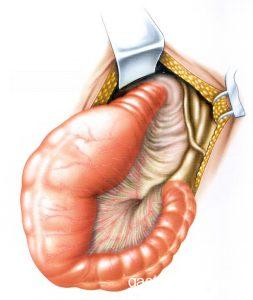
- Técnica de Habr-Gama: nos anos 1990, após surgimento e aprimoramento dos grampeadores e suturas mecânicos foi proposta a retossigmoidectomia com ressecção do reto abaixo do promontório e subsequente anastomose primária na parede posterior do reto distal, término-lateral mecânica extraperitoneal com grampeador de 33 mm (acima do anel anorretal a cerca de 5-7cm da borda anal – Figura 3). O racional da técnica é exclusão boa parte do reto doente do trânsito intestinal, evitando assim a manipulação anterior, que teoricamente teria probabilidade de denervação autonômica e risco de lesão de órgãos e estruturas pélvicas, como a vagina, bexiga, próstata, vesículas seminais e uretra.
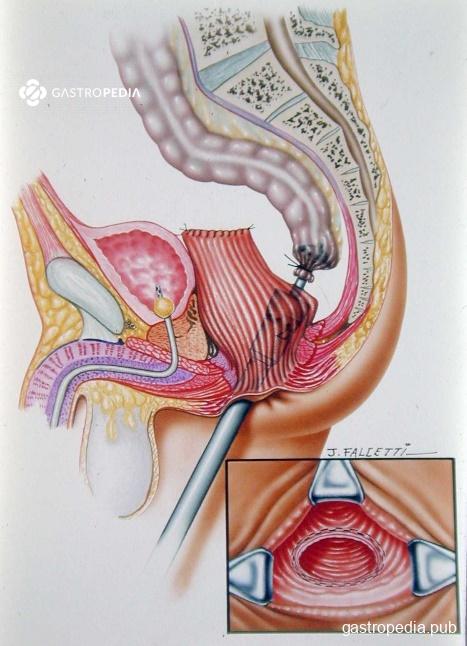
Essa é a técnica mais utilizada atualmente, sendo ainda mais difundida com o advento da videolaparoscopia. Apresenta taxa média de recorrência de 15-20%, certamente relacionada ao tempo de seguimento, que quanto maior apresenta maiores taxas.
Conheça nosso curso Gastroenterologia do Consultório e saiba como lidar com as queixas mais comuns que encontramos no dia a dia
Referências
- Santos Júnior JCM. Megacólon – Parte II: Doença de Chagas. Rev Bras Coloproct, 2002(4):266-277
- Alves RMA, Thomaz RP, Almeida EA, Wanderley JS, Guariento ME. Chagas’ disease and ageing: the coexistence of other chronic diseases with Chagas’ disease in elderly patients. Revista da Sociedade Brasileira de Medicina Tropical. 2009; 42(6):622-8
- Nahas SC, Dias AR, Dainezi MA, Araújo SEA, Nahas CSR. A Vídeo-Cirurgia no Tratamento do Megacólon Chagásico. Rev bras Coloproct, 2006;26(4): 470-4
- Kamiji MM, Oliveira RB. O perfil dos portadores de doença de Chagas, com ênfase na forma digestiva, em hospital terciário de Ribeirão Preto, SP. Revista da Sociedade Brasileira de Medicina Tropical. 2005; 38(4):305-9
- Araújo SEA, Dumarco RB, Rawet V, Seid VE, Bocchini SF, Nahas SC. Depopulation of intersticial cells of Cajal in chagasic megacolon: towards tailored surgery? Arq Bras Cir Dig. 2010;32(2):81-5
- Silva AL, Giacomin RT, Quirino VA, Miranda ES. Proposta de classificação do megacólon chagásico através de enema opaco. Rev Col Bras Cir. 2003;30(1):4-10
- Cavenaghi S, Felicio OCS, Ronchi LS, Cunrath GS, Melo MMC, Netinho JG. Prevalence of rectoanal inhibitory reflex in chagasic megacolon. Arq Gastroenterol. 2008;45(2):128-31
- Nahas SC. Tratamento cirúrgico do megacólon chagásico pela retossigmoidectomia abdominal com anastomose mecânica colorretal término-lateral posterior imediata. Tese Professor Livre Docente, USP, São Paulo, 2000.
- Nahas SC, Pinto RA, Dias AR, Nahas CSR, Araújo SEA, Marques CFS, Cecconello I. Long-term follow up of abdominal rectosigmoidectomy with posterior end-to-side stapled anastomosis for Chagas megacolon. Olorectal Dis. 2011;13(3):317-22.
Como citar este artigo
Pinto RA, Neto IJFC, Camargo MGM, Nahas SC, Marques CFS. Megacolon Chagasico: Diagnóstico e Tratamento Gastropedia 2024, Vol.1 Disponível em: gastropedia.pub/pt/cirurgia/colorretal/megacolon-chagasico-diagnostico-e-tratamento/