Doença diverticular do cólon: epidemiologia e fisiopatologia
1. INTRODUÇÃO
A doença diverticular do cólon é uma patologia onde pequenos sacos são formados por uma protrusão geralmente no ponto de penetração da artéria nutriente (vasa recta) que irriga a mucosa e a submucosa. É uma doença crônica com um amplo espetro de sintomas abdominais que eventualmente podem agudizar.
A doença diverticular do colón afeta mais da metade dos indivíduos acima dos 60 anos de idade. No entanto, apenas 20% dos doentes desenvolvem sintomas desta condição.
Existe amplo espectro de apresentações clínicas dos divertículos de cólon. O detalhamento do quadro clínico será discutido em outro artigo. Neste artigo, focaremos na fisiopatologia da doença diverticular e de suas complicações. No entanto, é importante entender a diferença de nomenclaturas utilizadas para descrever cada condição. Resumidamente:
- Diverticulose ou Doença diverticular assintomática: é a simples presença de divertículos no cólon. Pode ser assintomática ou sintomática. A maioria das pessoas com divertículos do cólon permanece assintomática. Sintomas atribuídos a diverticulose aparecem em cerca de 25-30% dos indivíduos. Alguns autores reservam o termo doença diverticular apenas para a diverticulose sintomática, embora no nosso meio esses termos sejam usados como sinônimos.
- Doença diverticular sintomática pode variar conforme sua apresentação clínica, desde a Doença diverticular sintomática não complicada, que tipicamente manifesta-se por dor abdominal localizada, sensação de gases e alterações do habito intestinal, até a Doença diverticular complicada, como a diverticulite aguda e a hemorragia diverticular.
2. EPIDEMIOLOGIA
A doença diverticular é uma das desordens gastrointestinais mais comuns nos países ocidentais, e acredita-se que sua incidência tenda a aumentar, sendo proporcional com o envelhecimento da população. A diverticulose do cólon é o achado mais comum na colonoscopia.
A distribuição destes divertículos varia com a raça, mas não com o sexo.
No ocidente, 80-90% situam-se no cólon esquerdo. Na população asiática a diverticulose predomina no cólon direito (80%). Frequência de diverticulose a direita tem aumentado no ocidente ultimamente.
A prevalência da diverticulose é menor que 20% na população com menos de 40 anos, comparado com cerca de 60% nos indivíduos com mais de 70 anos de idade.
A diverticulose geralmente cursa sem sintomas ao longo da vida. A diverticulite aguda ocorre em menos de 5% dos doentes com diverticulose e destes, 20% terão diverticulite complicada.
Depois da recuperação do primeiro episódio, 15 a 20% podem apresentar recorrência.
3. FISIOPATOLOGIA
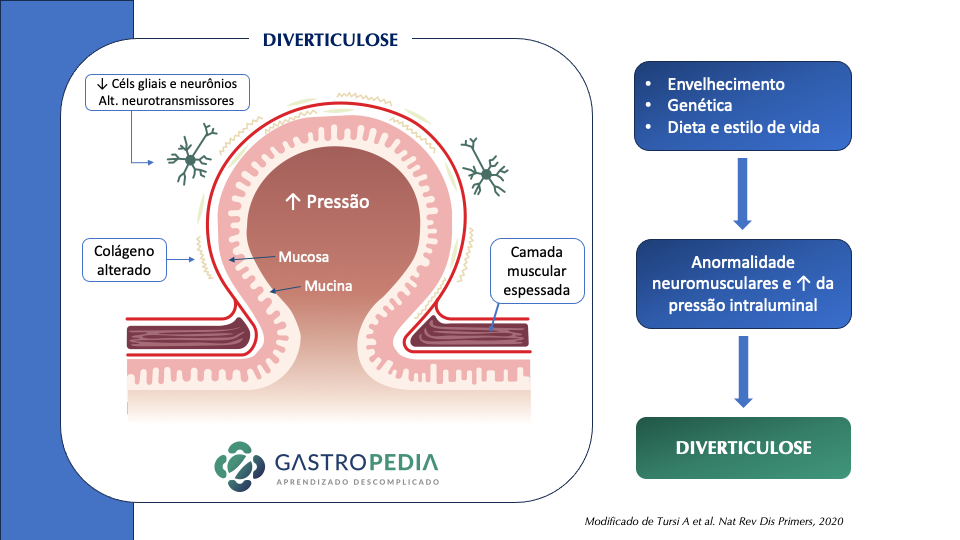
O mecanismo fisiopatológico envolvido na doença diverticular é complexo e não está completamente compreendido. A diverticulose parece estar ligada à formação de divertículos através de altas pressões na mucosa do cólon em locais de fraqueza onde arteríolas penetram a camada muscular circular para fornecer nutrientes à mucosa. Estas arteríolas advêm de colaterais das artérias mesentérica superior e inferior através da arcada de Riolan, da artéria marginal de Drummond e uma série de outras arcadas. As arcadas terminais por fim penetram a camada muscular pela vasa recta para formar o plexo submucoso. Assim, contrações de elevada amplitude associadas a obstipação e elevado conteúdo de gordura nas fezes no lúmen do cólon sigmóide resultam na criação destes divertículos. Os divertículos ocorrem mais frequentemente no cólon sigmoide estando relacionados a pressão e o tipo de conteúdo intraluminal.
Divertículo falso ou verdadeiro? Na população ocidental, os divertículos são causados por inversão das camadas mucosa e submucosa, mas não da camada muscular, portanto, são denominados falsos divertículos ou pseudodivertículos. Na população oriental, a inversão pode envolver todas as camadas da parede do cólon e esses divertículos são, portanto, referidos como divertículos “verdadeiros”.
Existem três fatores principais envolvidos na fisiopatologia da doença diverticular:
- Alterações da parede do cólon
- aumento da pressão intracólica (dismotilidade)
- Dieta pobre em fibras (fezes endurecidas)
3.1 Alterações na parede:
Existe um espessamento atribuído à deposição de elastina entre as células musculares na taenea, verificando-se um aumento da síntese de colégeno tipo III. Isso leva a um encurtamento das tênias colônicas com espessamento da camada muscular circular e redução do calibre do órgão, processo conhecido como myochosis coli. Verifica-se uma expressão acentuada do inibidor tecidual de metaloproteinases, que regula a deposição de proteínas na matrix extracelular, o que poderá levar ao aumento da elastina e colágeno. Estes achados parecem estar em harmonia com a incidência mais alta da diverticulose nas doenças do tecido conjuntivo.
- diversos autores referem espessamento da camada muscular como fator que precede o divertículo, pois esta hipertrofia causaria aumento da pressão intracolônica e aumento do número de ondas motoras.
3.2 Distúrbios da motilidade do cólon:
- Segundo Painter (TEORIA DA SEGMENTAÇÃO NÃO-PROPULSIVA) (Painter NS, et al. Gastroenterology. 1965), o cólon atua em segmentos separados em vez de funcionar como um tubo contínuo. Havendo progressão desta segmentação, as pressões altas são direcionadas à parede do cólon em vez de desenvolver ondas de propulsão para mover o conteúdo intestinal distalmente.
- Postulou a teoria da segmentação cólica onde a contração da musculatura lisa em sintonia com as pregas semilunares da mucosa levaria ao aparecimento de múltiplas câmaras (que corresponderiam às haustrações) onde a pressão estaria aumentada favorecendo a pulsão da mucosa contra os pontos de fraqueza na parede cólica na entrada dos vasos retos levando então ao aparecimento dos divertículos.
- A atividade mioelétrica também parece estar alterada na doença. Foi demonstrado em diversos estudos mais atuais que na doença diverticular existem menos células de Cajal e células gliais e uma variabilidade na expressão de certos neuropeptídeos
- Alterações da motilidade cólica resultam em aumento das pressões de repouso no cólon de indivíduos com doença diverticular.
- O cólon sigmoide por ter a maior pressão no cólon e ser o segmento mais estreito é o mais acometido.
- A observação de pressões elevadas de repouso e induzidas no cólon direito de pacientes asiáticos com divertículos proximais também foi publicada, sugerindo que a dismotilidade proximal também exerce papel na origem de divertículos do cólon direito.
3.3 Dieta:
- A grande variação na prevalência dessa afecção, bem como sua estreita correlação com a dieta ocidental sugerem a existência de um fator etiológico presente na dieta.
- Painter e Burkitt (Painter NS and Burkitt DP. Brit Medical.1971) observaram em mais de 1.200 habitantes do Reino Unido e de Uganda que os primeiros, ingerindo dieta ocidental pobre em fibra e refinada (massa fecal diária de aproximadamente 110 gramas), exibiam tempo de trânsito intestinal menor do que os africanos que se alimentavam de dieta rica em fibras e tinham massa fecal avaliada em aproximadamente 450 gramas por dia. Postulou-se que tempos de trânsito intestinal prolongado com fezes pouco volumosas resultantes de dieta pobre em fibras levariam a significativo aumento das pressão intraluminal e predisporiam à formação de divertículos.
- No entanto, quando olhamos para uma população inteiramente ocidental, tais diferenças na composição da dieta e na duração do tempo de trânsito não foram elucidativas. Tampouco estudos de intervenção estão disponíveis para comprovar a evidência epidemiológica.
4. Fisiopatologia das complicações da doença diverticular
4.1 Fisiopatologia da Diverticulite Aguda
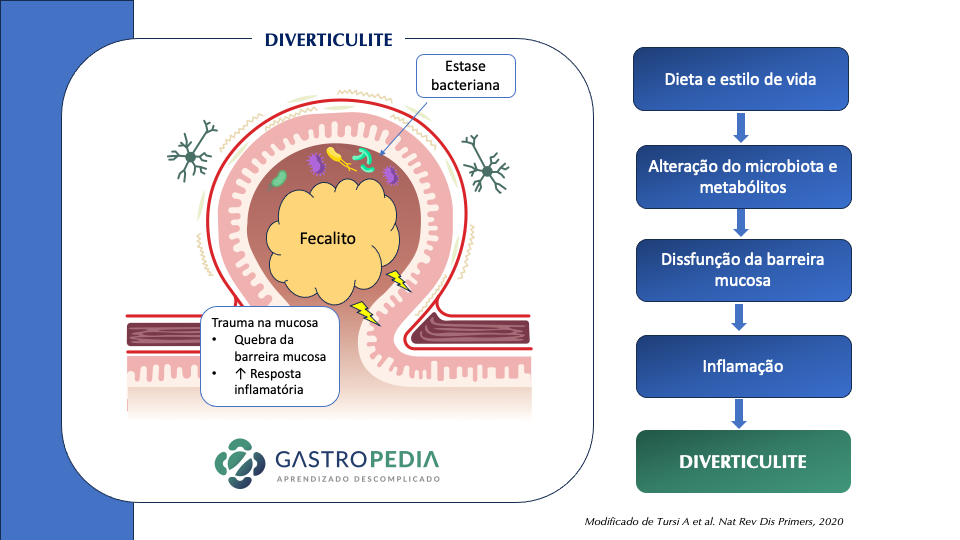
A causa subjacente da diverticulite é a perfuração micro ou macroscópica de um divertículo. Os mecanismos que levam a essa perfuração não são bem elucidados e provavelmente a causa é multifatorial. Anteriormente, acreditava-se que a obstrução dos divertículos (por exemplo, por fecalitos) aumentava a pressão intradiverticular e causava perfuração. No entanto, essa obstrução nem sempre está presente.
Acredita-se que o processo seja multifatorial:
- Alteração do microbiota levando a disfunção da barreira mucosa
- Inflamação crônica local
- Trauma local com erosão da parede diverticular por aumento da pressão intraluminal e fecalitos
- Seguem inflamação e necrose focal, resultando em perfuração
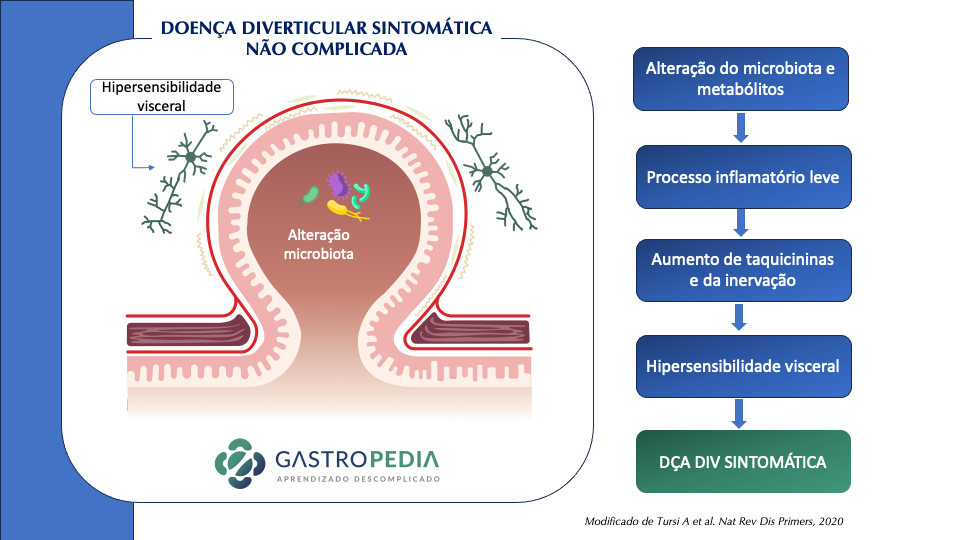
Recentemente, descobriu-se que também existe uma inflamação de baixo grau contínua no segmento de cólon acometido. Esta inflamação leva a hipertrofia muscular e ao remodelamentodos nervos entéricos levando a hipersensibilidade visceral e alteração da motilidade. Estas mudanças podem ser a razão da dor abdominal recorrente e distúrbios gastrointestinais posteriormente a um episódio de diverticulite.
Outro fator que também parece ter algum papel na fisiopatologia é a microbiota intestinal. Em diversos estudos, na diverticulite a diversidade de Proteobacteria foi maior em relação ao controle. Também apresenta um maior número de macrófagos e uma depleção de Clostridium cluster IV. Na diverticulose sintomática, parece estarem reduzidos o Clostridium cluster IX, Fusobacterium, e Lactobacillaceae, comparados com as pessoas com diverticulose sem sintomas.
Confira esse artigo: Tratamento da Diverticulite Aguda
4.2 Fisiopatologia do sangramento diverticular
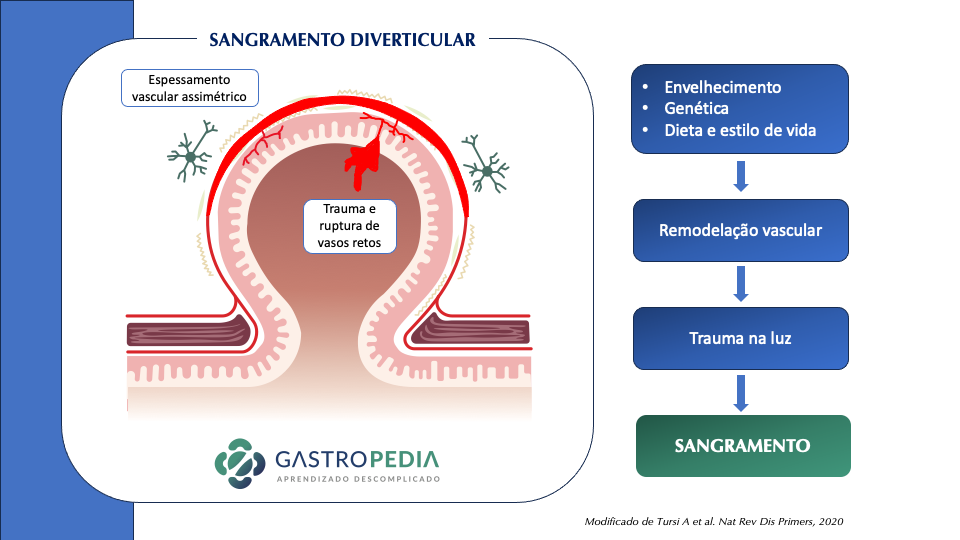
Com relação à FISIOPATOLOGIA DO SANGRAMENTO DIVERTICULAR, após a herniação diverticular no ponto de fraqueza dos vasos, a vasa recta fica mais exposta ao conteúdo colônico, levando a espessamento da camada íntima e adelgaçamento da camada média, que predispõe a ruptura para o lumen.
Confira esse artigo: Hemorragia Diverticular: quadro clínico e tratamento
5. Fatores de risco
Diversos fatores de risco já foram correlacionados com a doença diverticular, incluindo ingesta de carne vermelha, dieta pobre em fibras, sedentarismo, IMC > 25 Kg/m2 e tabagismo. TODOS OS GUIDELINES COLOCAM A OBESIDADE, DIETA POBRE EM FIBRAS E SEDENTARISMO COMO FATORES DE RISCO PARA DOENÇA DIVERTICULAR.
REFERÊNCIAS
Tursi A, Scarpignato C, Strate LL, Lanas A, Kruis W, Lahat A, Danese S. Colonic diverticular disease. Nat Rev Dis Primers. 2020 Mar 26;6(1):20. doi: 10.1038/s41572-020-0153-5. PMID: 32218442
Como citar esse artigo
Martins BC. Doença diverticular do cólon: epidemiologia e fisiopatologia. Em Gastropedia 2023, vol 1. Disponível em: https://gastropedia.pub/pt/cirurgia/doenca-diverticular-do-colon-epidemiologia-e-fisiopatologia