Endoluminal Functional Lumen Imaging Probe (EndoflipTM): conhecendo a tecnologia e seus potenciais usos
O EndoflipTM é uma técnica inovadora que utiliza a tecnologia de planimetria por impedância para avaliar a distensibilidade de órgãos gastrointestinais.
Apesar de desenvolvido em 2009, o seu uso ainda é restrito a ambientes de pesquisa devido ao custo elevado e à necessidade de maiores evidências para melhor padronização do método.
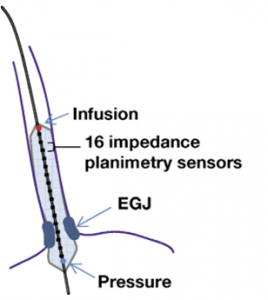
Consiste de um cateter que apresenta em sua extremidade distal um balão distensível de 8 ou 16 cm (Figuras 1 e 2). Neste balão, estão localizados 16 pares de sensores de planimetria por impedância, que são capazes de medir a área de secção transversal de um plano do órgão (planimetria) utilizando a resistência elétrica (impedância) do fluido existente no balão.
Na extremidade distal do cateter, está localizado ainda um transdutor de pressão, que é responsável por aferir a pressão dentro do balão. Desta forma, dividindo-se a área transversal pela pressão, podemos determinar o Índice de Distensibilidade em reposta à distensão controlada por volume.
A grande parte dos estudos com o EndoflipTM foi realizada para avaliação esofágica. Para tal, o cateter é introduzido com o paciente sedado, geralmente após a endoscopia digestiva alta.
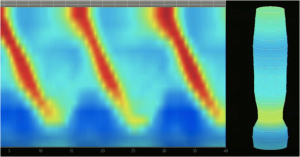
Com a introdução do EndoflipTM 2.0 em 2017, foi associado ainda um sistema de topografia, que permite avaliar a motilidade esofágica (se ausência de ondas, se contrações anormais retrógradas ou contrações normais anterógradas) – Figura 3.
As potenciais aplicações do método são:
1. Avaliação de disfagia e acalásia
- Destaque naqueles pacientes com clínica suspeita de acalásia, mas dúvida diagnóstico devido relaxamento normal da junção esofagogástrica (JEG) em exame de manometria;
- Utilidade em pacientes que não conseguem realizar a manometria por não tolerarem o desconforto da sonda (o EndoflipTM é realizado sedado);
- Índice de distensibilidadeda JEG > 3 mm2/mmHg e contrações anterógradas sugerem normalidade (Figura 3);
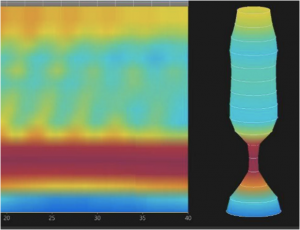
- Índice de distensibilidade£ 1.6 mm2/mmHg da JEG, bem como ausência de contrações (figura 4) ou contrações repetitivas retrógradas (figura 5) sugerem acalásia.
- Nos casos de diagnóstico manométrico de obstrução ao fluxo da JEG, o Índice de Distensibilidade da JEG < 2 mm2/mmHg é associado a melhor resposta sintomática a terapias similares à da acalásia, enquanto valores > 3 mm2/mmHg são favoráveis ao seguimento conservador.

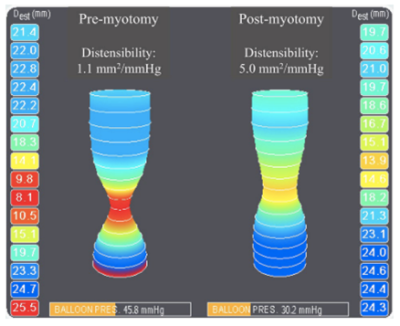
2. Uso intra-operatório para guiar ajustes em miotomias e fundoplicaturas
- Em miotomias, valores de Índice de Distensibilidade da JEG entre 4.5 e 8.5 mm2/mmHg sugerem melhores resultados (Figura 6);
- Em fundoplicaturas, valores de Índice de Distensibilidade da JEG entre 2 e 3.5 mm2/mmHg foram associadas com menor índice de disfagia e de refluxo após procedimento.
3. Avaliação na esofagite eosinofílica
- Identificar a distensibilidade esofágica, de modo a identificar estreitamentos fibroestenóticos que nem sempre são bem avaliados pela endoscopia.
- Potencial benefício em pacientes que persistem com disfagia a despeito da remissão histológica, podendo guiar possíveis dilatações.
4. Outros potenciais usos
- Avaliar distensibilidade do piloro em pacientes com suspeita de gastroparesia
- Avaliar canal anal em pacientes com incontinência.
Sugestão de conteúdo
Leitura:
Vídeo:
Podcast:
Como citar este artigo
Lages RB., Endoluminal Functional Lumen Imaging Probe (EndoflipTM): conhecendo a tecnologia e seus potenciais usos. Gastropedia, 2022. Disponível em: https://gastropedia.pub/pt/gastroenterologia/esofago/endoluminal-functional-lumen-imaging-probe-endofliptm-conhecendo-tecnologia-e-seus-potenciais-usos/
Referências Bibliográficas
- Dorsey YC, Posner S, Patel A. Esophageal Functional Lumen Imaging Probe (FLIP): How Can FLIP Enhance Your Clinical Practice? Dig Dis Sci 2020. Online ahead of print. doi:10.1007/s10620-020-06443-8.
- Hirano I, Pandolfino JE, Boeckxstaens GE. Functional Lumen Imaging Probe for the Management of Esophageal Disorders: Expert Review From the Clinical Practice Updates Committee of the AGA Institute. Clin Gastroenterol Hepatol 2017;15:325–34. doi:10.1016/j.cgh.2016.10.022.
- Su B, Novak S, Callahan ZM, Kuchta K, Carbray JA, Ujiki MB. Using impedance planimetry (EndoFLIPTM) in the operating room to assess gastroesophageal junction distensibility and predict patient outcomes following fundoplication. Surg Endosc 2020;34:1761–8. doi:10.1007/s00464-019-06925-5.
- Su B, Dunst C, Gould J, Jobe B, Severson P, Newhams K, et al. Experience-based expert consensus on the intra-operative usage of the endoflip impedance planimetry system. Surg Endosc 2020. doi:10.1007/s00464-020-07704-3.




