¿Cuándo indicar el contraste hepatoespecífico en la evaluación de lesiones focales hepáticas?
Rutinariamente, en la resonancia magnética (RM) del abdomen, se utiliza el contraste extracelular inespecífico (gadolinio), que se distribuye de acuerdo con la distribución de los vasos y capilares sanguíneos y determina, así, un patrón dinámico de impregnación de la lesión focal hepática en las fases arterial, portal (venosa) y equilibrio.
En casos seleccionados, se pueden indicar los contrastes intracelulares específicos, también denominados de hepato-específicos y que pueden ser de dos clases principales: (1) óxido de hierro superparamagnético y (2) hepatobiliares, siendo este último captado específicamente por las células hepáticas y con excreción renal (50%) y biliar (50%). En Brasil, está aprobado el contraste hepatobiliar, conocido como ácido gadoxético (Gd-EOB-DTPA, PrimovistÒ).
De esta manera, además de proporcionar los datos habituales del estudio dinámico, existe la etapa final de evaluación hepatobiliar, después de aproximadamente 10 a 20 minutos de la inyección endovenosa, en la cual el contraste entra en los hepatocitos a través de los transportadores de membrana (OATP1, B1/B3) y sale a través de proteínas dependientes de ATP resistentes a múltiples fármacos (MRP2, MRP3, MRP4), siendo el transportador MRP2 el encargado de excretar el contraste en el canalículo biliar.
¿Cuáles son las indicaciones del contraste hepatobiliar?
Sabiendo que el ácido gadoxético es captado por los hepatocitos y excretado en aproximadamente un 50% por la vía biliar, se espera que un tejido hepático normofuncionante sea impregnado por el contraste en la fase hepatobiliar. De esta manera, la no captación del ácido gadoxético en la fase hepatobiliar infiere que no hay hepatocitos o canalículos biliares viables en la lesión evaluada.
Podemos enumerar 3 indicaciones principales en el uso del ácido gadoxético en la evaluación de lesiones focales hepáticas:
1. Diferenciación entre hiperplasia nodular focal (HNF) y adenoma
El adenoma y la HNF son el tercer y segundo tumores hepáticos benignos más frecuentes, respectivamente.
El adenoma se caracteriza por cordones de hepatocitos y ausencia de conductos biliares o tractos portales, por lo tanto, no presenta captación en la fase hepatobiliar.
Por otro lado, la HNF se caracteriza por un conglomerado de hepatocitos hiperplásicos y pequeños canalículos biliares inmaduros que no se comunican con los más grandes, lo que puede generar una acumulación (retención) de contraste hepatobiliar en la fase hepatobiliar en relación con el parénquima hepático adyacente. También se puede encontrar una cicatriz fibrosa central que dirige el patrón de la lesión hacia la HNF.
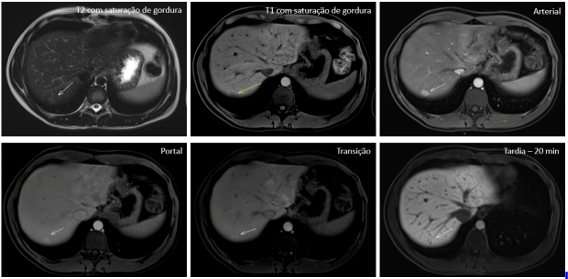
Fuente: archivo personal, en colaboración con la Dra. Ângela Caiado
Figura 1. Nódulo hipervascularizado en el segmento VII hepático, de 1,2 cm, con un patrón de retención del contraste hepatoespecífico (fase tardía, 20 minutos), compatible con hiperplasia nodular focal.
2. Evaluación de nódulos hepáticos en pacientes cirróticos
- Nódulos regenerativos y displásicos x neoplásicos (carcinoma hepatocelular, CHC)
- Identificación de pequeños CHCs (<2cm) y mejor evaluación de lesiones focales con comportamiento atípico en examen contrastado previo, con realce inespecífico.
El CHC es el tumor primario del hígado más común. En el paciente cirrótico, un nódulo igual o mayor que 2,0 cm de diámetro, con patrón típico hipervascular en la fase arterial (wash-in) y con aclaramiento en las fases tardías (wash-out) se diagnostica como CHC.
En lesiones menores de 2 cm, los hallazgos típicos no suelen verse con frecuencia, especialmente en los CHC iniciales bien diferenciados. En estos casos, el estudio con contraste hepatobiliar puede contribuir con hallazgos adicionales, siendo desafiante la distinción entre el nódulo displásico de alto grado y el CHC bien diferenciado.
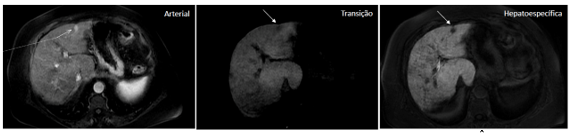 Fuente: archivo personal, en colaboración con la Dra. Ângela Caiado
Fuente: archivo personal, en colaboración con la Dra. Ângela Caiado
Figura 2. Nódulo en la cara anterior del segmento II/III, de 1,2 cm, con realce en la fase arterial, aclaramiento precoz y sin retención en la fase hepatoespecífica.
3. Evaluación de metástasis hepáticas
Las lesiones metastásicas no tienen hepatocitos o conductos biliares funcionantes, por lo tanto, no hay captación de contraste en la fase hepatobiliar. Además, la captación del contraste hepatobiliar por los hepatocitos del parénquima normal aumenta la diferencia de contraste con las lesiones metastásicas (hiperintensas), aumentando la sensibilidad de la detección de las mismas.
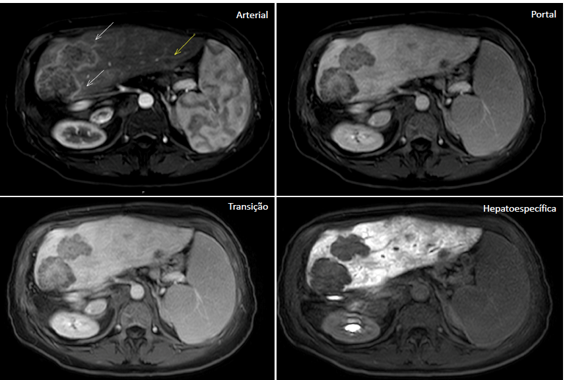 Fuente: archivo personal, en colaboración con la Dra. Ângela Caiado
Fuente: archivo personal, en colaboración con la Dra. Ângela Caiado
Figura 3. Metástasis hepáticas en paciente con neoplasia de colon. Se observan signos de hepatectomía derecha con aumento compensatorio del lóbulo izquierdo. En las lesiones metastásicas, se nota realce arterial periférico con lavado y ausencia de retención en la fase hepatoespecífica.
En resumen, en la Tabla 1, se pueden identificar los patrones típicos de las lesiones hepáticas focales en las fases contrastadas.
Tabla 1. Características de las lesiones hepáticas focales en las fases dinámicas y hepatobiliar
 CHC: Carcinoma hepatocelular
CHC: Carcinoma hepatocelular
Puntos de reflexión sobre el contraste hepatobiliar
Además del mayor costo, se describe en la literatura la mayor ocurrencia de artefactos respiratorios después de la inyección del contraste hepatobiliar en la fase arterial en algunos pacientes, lo que podría estar relacionado con la dificultad para mantener la apnea y/o la disnea subjetiva.
Conclusión
El contraste hepatobiliar aumenta la precisión diagnóstica en la detección y caracterización de lesiones focales hepáticas, especialmente las mencionadas en la Tabla 1, y deben evaluarse de acuerdo con el cuadro clínico de los pacientes.
Los nódulos con patrón atípico en los exámenes contrastados deben evaluarse caso por caso, pudiendo indicarse la biopsia hepática para una adecuada elucidación o exámenes de imagen periódicos para seguimiento.
Referencias
- Palmucci S. Detección y caracterización de lesiones hepáticas focales: Las ventajas de la RM hepática mejorada con ácido gadoxético. World J Hepatol. 2014 Jul 27;6(7):477-85. doi: 10.4254/wjh.v6.i7.477. PMID: 25067999; PMCID: PMC4110539.
- Asociación Europea para el Estudio del Hígado (EASL). Guías de práctica clínica de la EASL sobre el manejo de los tumores hepáticos benignos. J Hepatol. 2016 Aug;65(2):386-98. doi: 10.1016/j.jhep.2016.04.001. Epub 2016 Apr 13. PMID: 27085809.
- Lesiones hepáticas hiperintensas en la fase hepatobiliar de la RM mejorada con ácido gadoxético: apariencias de imagen e importancia clínica. Nobuhiro Fujita, Akihiro Nishie, Yoshiki Asayama, Kousei Ishigami, Yasuhiro Ushijima, Daisuke Kakihara, Tomohiro Nakayama, Koichiro Morita, Keisuke Ishimatsu, y Hiroshi Honda. RadioGraphics 2020 40:1, 72-94.
- Moosavi, B., Shenoy-Bhangle, A.S., Tsai, L.L. et al. Caracterización de la RM de las lesiones hepáticas focales en pacientes no cirróticos: evaluación del valor añadido de la imagen en la fase hepatobiliar mejorada con ácido gadoxético. Insights Imaging 11, 101 (2020). https://doi.org/10.1186/s13244-020-00894-3.
- Roberts LR, Sirlin CB, Zaiem F, Almasri J, Prokop LJ, Heimbach JK, Murad MH, Mohammed K. Imagen para el diagnóstico del carcinoma hepatocelular: una revisión sistemática y meta-análisis. Hepatology. 2018 Jan;67(1):401-421. doi: 10.1002/hep.29487. Epub 2017 Nov 29. PMID: 28859233.
- Koh, DM., Ba-Ssalamah, A., Brancatelli, G. et al. Informe de consenso del 9º Foro Internacional para la Resonancia Magnética Hepática: aplicaciones de la imagen mejorada con ácido gadoxético. Eur Radiol 31, 5615–5628 (2021). https://doi.org/10.1007/s00330-020-07637-4.
- Glessgen CG, Breit HC, Block TK, Merkle EM, Heye T, Boll DT. Anomalías respiratorias asociadas con el ácido gadoxético y el gadoterato meglumina: RM con compresión de la sensibilidad que revela fenómenos fisiológicos durante todo el ciclo de inyección. Eur Radiol. 2022 Jan;32(1):346-354. doi: 10.1007/s00330-021-08114-2. Epub 2021 Jul 29. PMID: 34324024; PMCID: PMC8660712.
Cómo citar este artículo
Oti KST; Gamarra ACQ. ¿Cuándo indicar el contraste hepatobiliar en la evaluación de lesiones focales hepáticas? Gastropedia 2025, vol. 2. Disponible en: https://gastropedia.pub/es/gastroenterologia/cuando-indicar-el-contraste-hepatoespecifico-en-la-evaluacion-de-lesiones-focales-hepaticas/
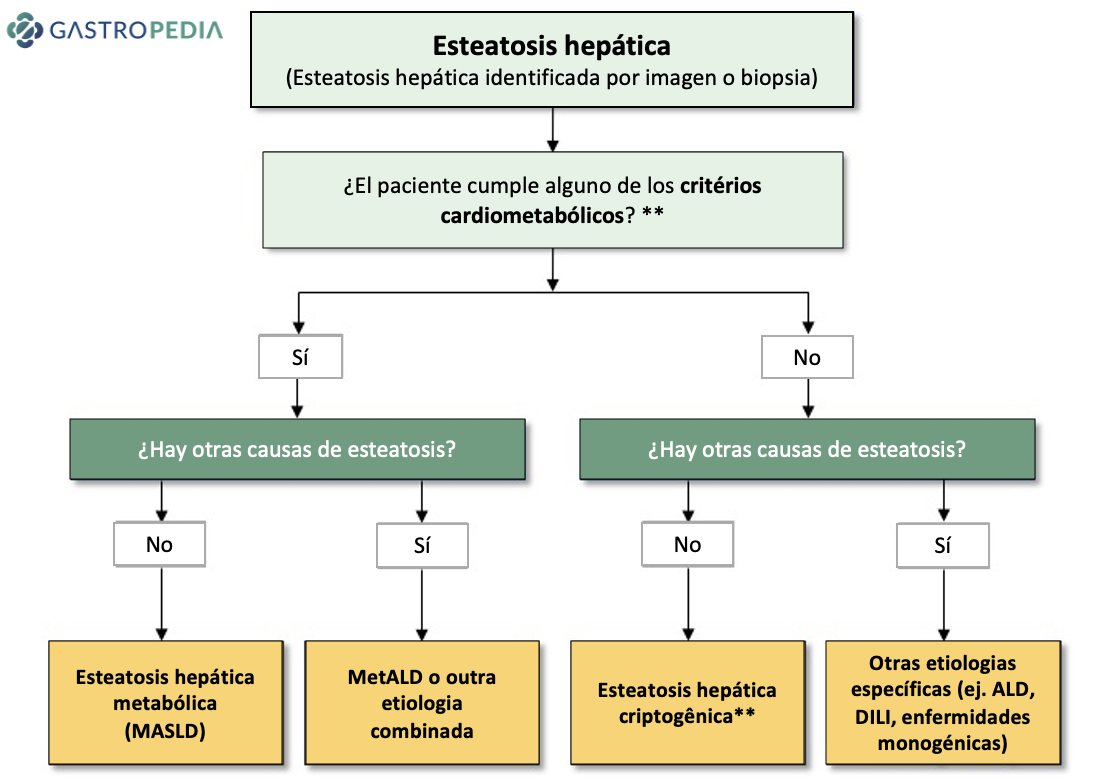
 Figura 1. Enfermedad hepática esteatósica y su subclasificación. Fuente: Nueva nomenclatura de enfermedad hepática esteatósica. ALEH, 2023. Disponible en:
Figura 1. Enfermedad hepática esteatósica y su subclasificación. Fuente: Nueva nomenclatura de enfermedad hepática esteatósica. ALEH, 2023. Disponible en: 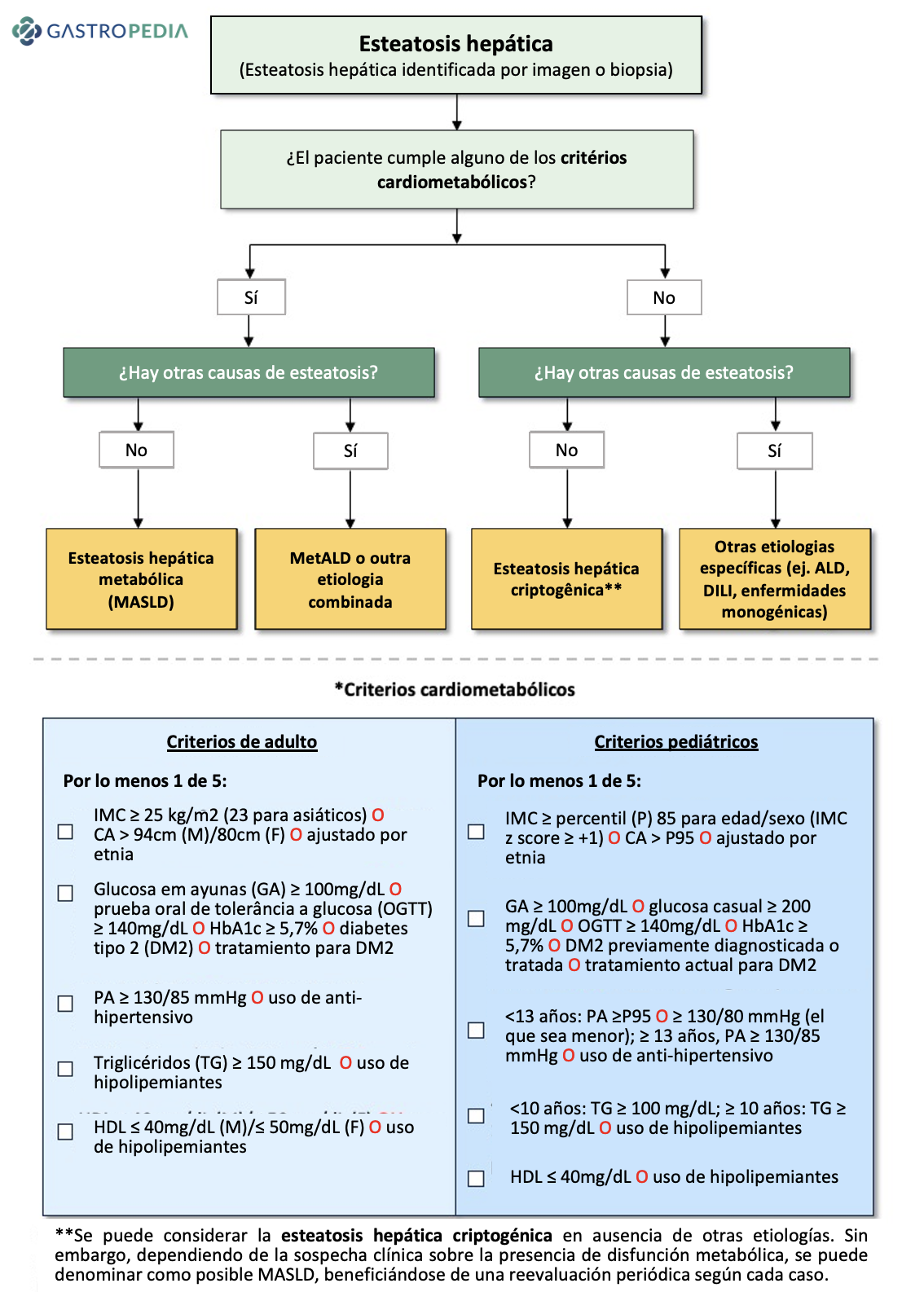 Figura 2. Criterios diagnósticos para MASLD. Adaptado de Rinella ME, Lazarus JV, Ratziu V et al.
Figura 2. Criterios diagnósticos para MASLD. Adaptado de Rinella ME, Lazarus JV, Ratziu V et al.