Investigación de Hepatitis Medicamentosa (Drug-Induced Liver Injury – DILI): conceptos principales y línea de razonamiento
Aspectos Generales
La hepatitis medicamentosa (Drug-induced liver injury, DILI) es uno de los cuadros más desafiantes en Hepatología debido a la amplia disponibilidad de medicamentos, suplementos y hierbas con potencial de hepatotoxicidad heterogéneo, variando desde una leve elevación de enzimas hepáticas hasta hepatitis aguda pronunciada e insuficiencia hepática fulminante (IHF).
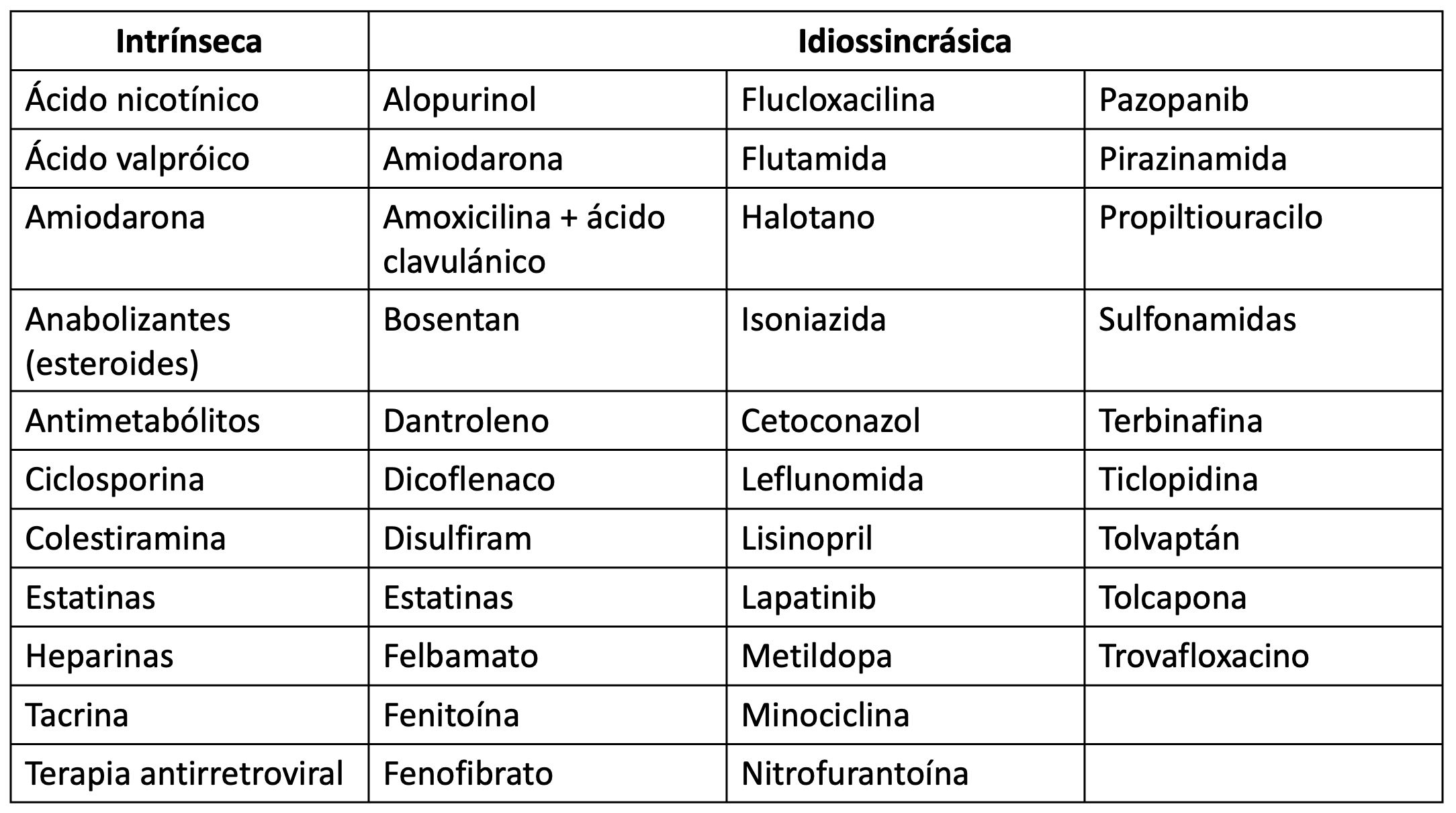
Tradicionalmente, DILI puede clasificarse como intrínseca (o directa) versus idiosincrásica. La primera es típicamente relacionada con la dosis y ocurre en la mayoría de los pacientes expuestos a un medicamento, ocurriendo dentro de un corto período de tiempo (horas a días). Ya DILI idiosincrásica usualmente no es dependiente de la dosis, ocurre en una menor proporción de individuos expuestos (impredecible) y presenta una latencia variable entre días a semanas.
Un prerrequisito común para DILI intrínseca e idiosincrásica es el metabolismo de drogas lipofílicas en el hígado, generando metabolitos reactivos que llevan a la unión covalente, estrés oxidativo mitocondrial y del retículo endoplasmático. Tales consecuencias pueden resultar (a) directamente en necrosis o apoptosis [intrínseca] o (b) en respuesta inmune adaptativa [idiosincrásica] en individuos genéticamente susceptibles. Las principales drogas relacionadas con DILI se encuentran en la Tabla 1.
Patrones de DILI
Existen 3 patrones de DILI evaluados por la elevación de enzimas hepáticas:
- Hepatocelular: si ALT aislada ≥ 5x límite superior de la normalidad (LSN) o Factor R ≥ 5
- Colestático: si FA aislada ≥ 2x LSN o Factor R ≥ 2
- Mixto: Factor R > 2 a < 5
Recomendación
DILI debe ser clasificada como hepatocelular, colestática o mixta de acuerdo con el patrón de elevación de enzimas hepáticas de la primera dosificación de laboratorio en relación al evento clínico. Grado B (EASL, 2019).
Tés, Hierbas y Fitoterápicos
La hepatotoxicidad por tés, hierbas, fitoterápicos y suplementos está relacionada a diferentes factores que coexisten: falta de adecuada identificación de la planta, selección de la parte errada de la planta medicinal, almacenamiento inadecuado modificando el producto nativo, adulteración durante el procesamiento y etiquetado incorrecto del producto.
Otro desafío es la falta de claridad en la real composición de preparaciones a base de plantas, en especial, de multicomponentes. Se resalta aún que un producto fitoterápico puede ser contaminado por compuestos tóxicos que llevan a la hepatotoxicidad, como contaminación por metales pesados, pesticidas, herbicidas o incluso microorganismos.
Se destacan algunos fitoterápicos que poseen nivel de evidencia de hepatotoxicidad:
- Plantas que contienen alcaloides pirrolizidínicos (especies Heliotropium, Senecia, Crotalaria, Symphytum y Gynura)
- Germander (“cola de caballo”)
- Kava-kava (Piper methysticum)
- Té verde (Camellia sinensis)
- Sena (Cassia angustifolia)
- Sacaca (Croton cajucara benth)
- Chaparral (Larrea tridentata)
- Poleo (Mentha pulegium)
- Cáscara sagrada (Rhamnus purshiana)
- Hierba de San Cristóbal (Cimicifuga racemosa)
- Noni (Morinda citrifolia), entre otras
Entre los suplementos alimentarios, se destacan:
- Contiene ácido úsnico (LipoKinetix, UCP-1, OxyElite)
- Hydroxycut
- Ácido linoleico
- Plethoryl (vitamina A y hormonas tiroideas)
- Esteroides anabolizantes androgénicos
Recomendación
Los suplementos alimentarios y fitoterápicos pueden ser considerados como potenciales agentes causantes de injúria hepática. Grado C (EASL, 2019).
Causalidad – Puntuaciones
Algunas puntuaciones pueden ser utilizadas en la evaluación de causalidad para DILI, de forma que los criterios de cronología (inicio y suspensión de la droga), curso de la reacción, factores de riesgo, exclusión de otras causas, manifestaciones extrahepáticas, reexposición, entre otros aspectos, son puntuados y clasificados en exclusión o diagnóstico posible, probable o definitivo para DILI:
- Council for International Organizations of Medical Sciences Scale/Roussel-Uclaf-Causality-Assessment-Method (CIOMS/RUCAM);
- Clinical Diagnostic Scale/Maria and Victorino Scale (CDS/M&V scale);
- Digestive Disease Week-Japan (DDW-J);
- DILIN Expert Opinion.
Se debe tener en mente, sin embargo, que las puntuaciones no sustituyen el juicio clínico, siendo, en realidad, una traducción, en puntuación cuantitativa, de la sospecha clínica de DILI.
Evaluación Laboratorial para Exclusión de Causas Alternativas
El diagnóstico de DILI se basa en la exclusión de causas alternativas de agresión hepática. El patrón de injúria hepática puede auxiliar en la investigación inicial para descartar las principales causas de hepatitis y colestasis (Figura 1).
Además, la edad y las comorbilidades, los hábitos individuales de los pacientes y las características regionales de enfermedades infecciosas que pueden afectar el hígado pueden guiar en la evaluación (Tabla 2) .
La exclusión de la enfermedad de Wilson con dosificación de ceruloplasmina debe ser realizada, en especial, en pacientes con menos de 40 años.
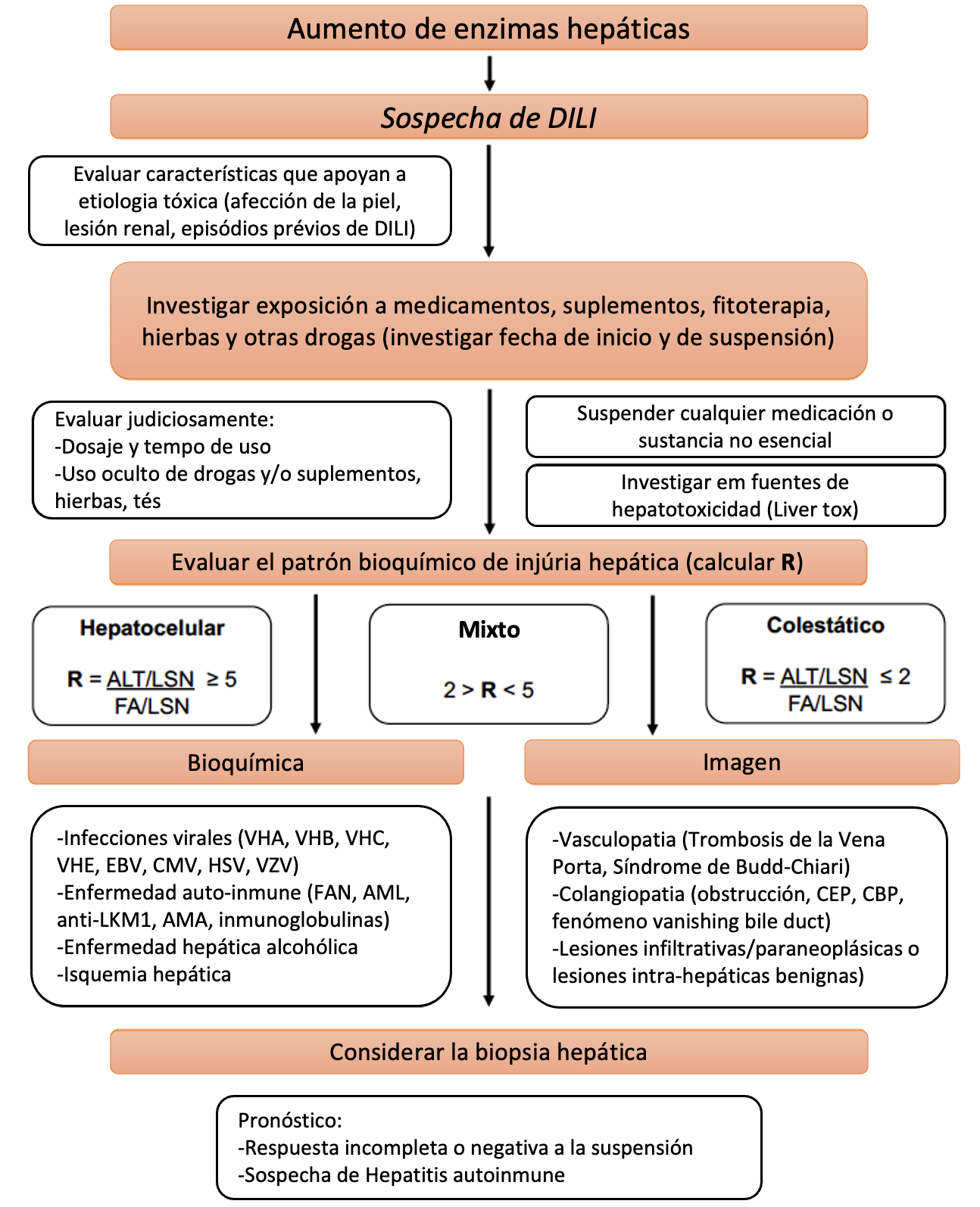
Tabla 1. Diagrama de flujo de investigación de DILI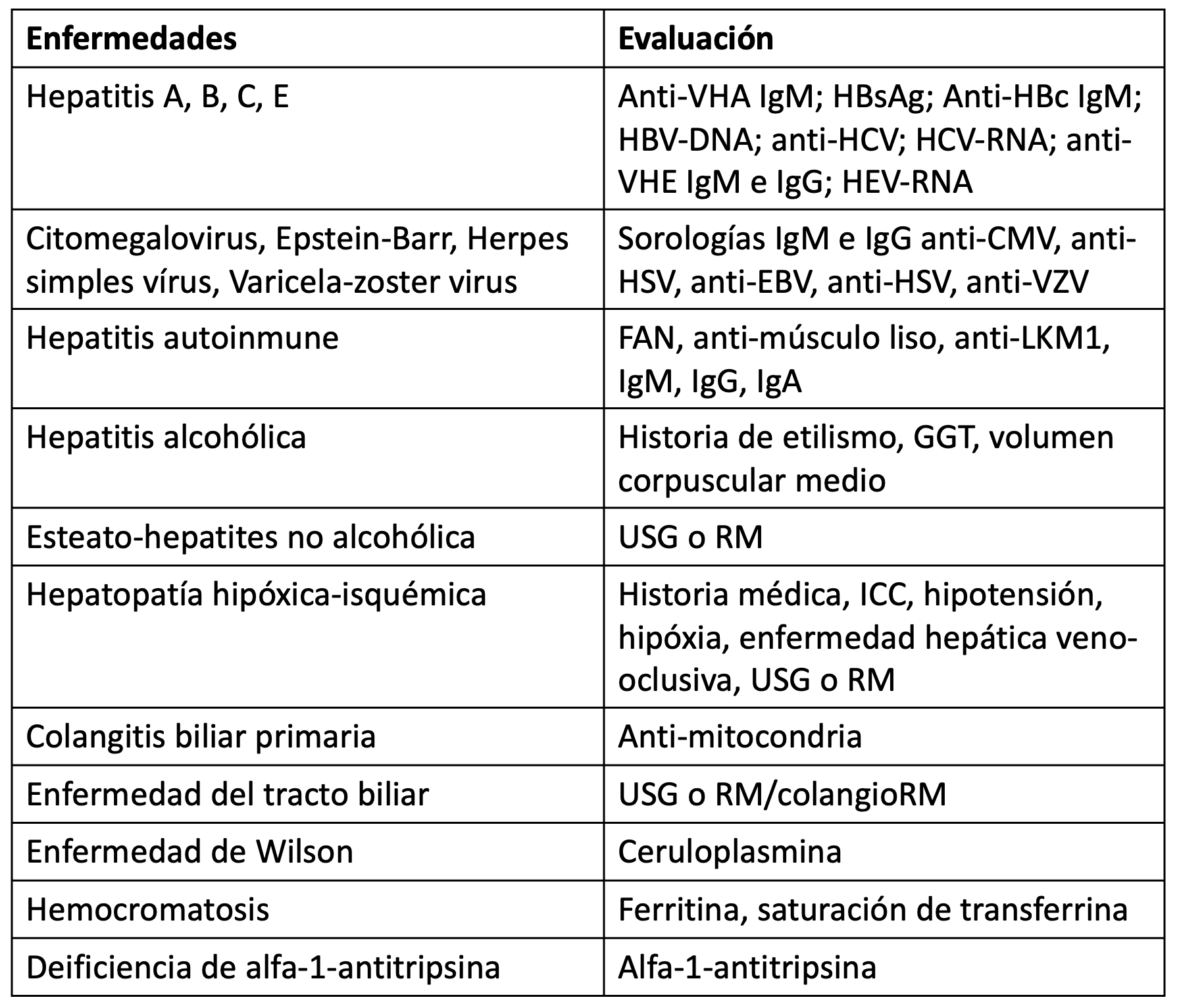
Tabla 2. Enfermedades hepáticas y exámenes en la investigación diagnóstica
Recomendación
La ecografía abdominal debe ser realizada en todos los pacientes con sospecha de DILI. Un examen de imagen adicional podrá ser indicado de acuerdo con el contexto clínico-laboratorial. Grado B (EASL, 2019).
Recomendación
La biopsia hepática puede ser considerada en pacientes seleccionados sospechosos para DILI, de forma que la histología hepática pueda proporcionar informaciones que fundamenten el diagnóstico de DILI o una alternativa (Grado D) o cuando los exámenes levanten la posibilidad de HAI (Grado C); EASL, 2019.
Conclusión
En resumen, el principal paso en el manejo de los casos de DILI es la suspensión de todas las drogas no esenciales, incluyendo formulaciones, suplementos, hierbas y tés. De esta forma, la mayoría de los pacientes cursará con recuperación espontánea clínica y/o laboratorial, sin la necesidad de medidas adicionales.
Pacientes con evidencia clínica o laboratorial de IHF, como encefalopatía hepática o coagulopatía, deben ser hospitalizados.
En general, la terapia medicamentosa queda reservada para situaciones específicas, como n-acetilcisteína en la intoxicación por paracetamol o DILI idiosincrásica con IHF o corticoides, si hay la posibilidad de hepatitis autoinmune o en la presencia de componentes de hipersensibilidad.
La reexposición a la droga (“rechallenge”) es el dato más definitivo para el diagnóstico de DILI (ALT>3xLSN), pero debe ser evaluada caso a caso, conforme la gravedad del episodio de DILI y necesidad de la terapia medicamentosa (ejemplo: agentes quimioterápicos o tuberculostáticos), bajo supervisión especializada y rigurosa.
Referencias
- European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu, Clinical Practice Guideline Panel: Chair:, Panel members, et al. EASL clinical practice guidelines: drug-induced liver injury. J Hepatol 2019;70:1222– 61.
- Brennan PN, Cartlidge P, Manship T, Dillon JF. Guideline review: EASL clinical practice guidelines: drug-induced liver injury (DILI). Frontline Gastroenterol. 2021 Jul 29;13(4):332-336. doi: 10.1136/flgastro-2021-101886. PMID: 35722609; PMCID: PMC9186030.
- Chalasani NP, Maddur H, Russo MW, Wong RJ, Reddy KR; Practice Parameters Committee of the American College of Gastroenterology. ACG Clinical Guideline: Diagnosis and Management of Idiosyncratic Drug-Induced Liver Injury. Am J Gastroenterol. 2021 May 1;116(5):878-898. doi: 10.14309/ajg.0000000000001259. PMID: 33929376.
- García-Cortés M, Stephens C, Lucena MI, Fernández-Castañer A, Andrade RJ. Causality assessment methods in drug induced liver injury: strengths and weaknesses. J Hepatol. 2011 Sep;55(3):683-691. doi: 10.1016/j.jhep.2011.02.007. Epub 2011 Feb 22. PMID: 21349301.
- Bessone F, García-Cortés M, Medina-Caliz I, Hernandez N, Parana R, Mendizabal M, Schinoni MI, Ridruejo E, Nunes V, Peralta M, Santos G, Anders M, Chiodi D, Tagle M, Montes P, Carrera E, Arrese M, Lizarzabal MI, Alvarez-Alvarez I, Caballano-Infantes E, Niu H, Pinazo J, Cabello MR, Lucena MI, Andrade RJ. Herbal and Dietary Supplements-Induced Liver Injury in Latin America: Experience From the LATINDILI Network. Clin Gastroenterol Hepatol. 2022 Mar;20(3):e548-e563. doi: 10.1016/j.cgh.2021.01.011. Epub 2021 Jan 9. PMID: 33434654.
Cómo citar este artículo
Oti KST, Gamarra ACQ. Investigación de Drug-Induced Liver Injury (DILI): principales conceptos y línea de razonamiento. Gastropedia 2024, vol. 2. Disponible en: https://gastropedia.pub/es/gastroenterologia/investigacion-de-hepatitis-medicamentosa-drug-induced-liver-injury-dili-conceptos-principales-y-linea-de-razonamiento


