O papel dos autoanticorpos no diagnóstico da doença celíaca
Já é bastante sabido que a sorologia é uma importante arma no diagnóstico da Doença Celíaca (DC), mas a melhor forma de utilizá-la ainda é uma dúvida bastante recorrente na rotina ambulatorial.
É preciso avaliar bem cada paciente antes de definir a melhor estratégia. Nos pacientes com baixa probabilidade de DC, por exemplo, não é recomendado combinar diversos autoanticorpos. Apesar desta conduta aumentar a sensibilidade, ela diminui a especificidade para o diagnóstico e, por esta razão, não é uma boa opção neste grupo de pacientes.
Por outro lado, quando estamos diante de um paciente com alta probabilidade da doença, mesmo se os autoanticorpos forem negativos, deve-se seguir a investigação com a realização de biópsias duodenais.
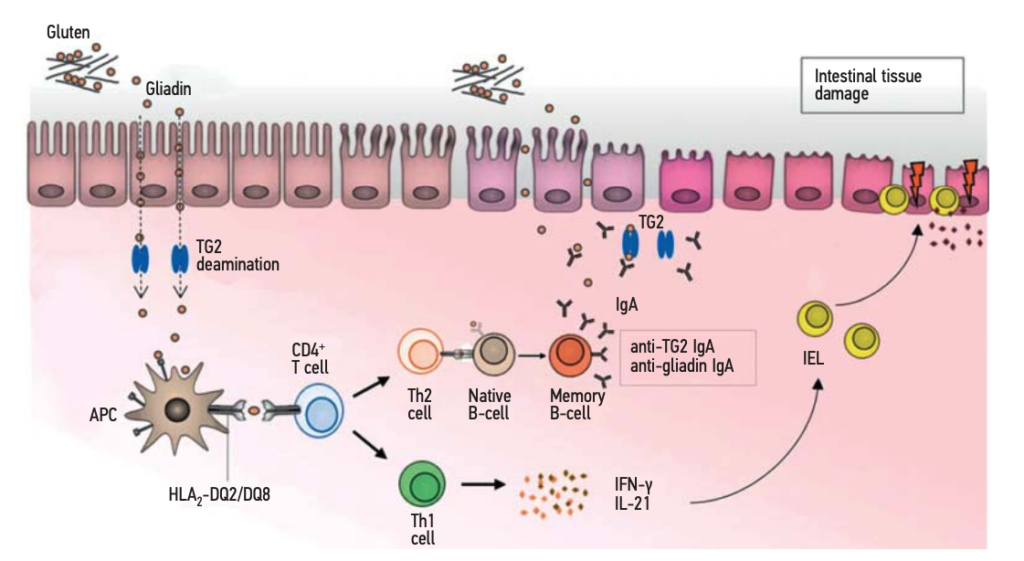
Se você ainda não conhece a fisiopatologia da Doença Celíaca, vale a pena conferir esse post (clique aqui) antes de estudar os autoanticorpos relacionados.
Autoanticorpos na Doença Celíaca
| Antígeno | Anticorpo | Sensibilidade % | Especificidade % |
| Gliadina | IgA IgG |
85 (57-100) 80 (42-100) |
90 (47-94) 80 (50-94) |
| Endomísio | IgA IgG |
95 (86-100) 80 (70-90) |
99 (97-100) 97 (95-100) |
| Transglutaminase tecidual | IgA IgG |
98 (78-100) 70 (45-95) |
98 (90-100) 95 (94-100) |
| Gliadina Deaminada | IgA IgG |
88 (74-100) 80 (70-95) |
90 (80-95) 98 (95-100) |
O anticorpo antigliadina foi usado por décadas no diagnóstico de DC, mas tem sua utilidade bastante limitada atualmente devido sua baixa performance quando comparada aos outros testes disponíveis.
A antitransglutaminase tecidual IgA (anti-tTG IgA) é o autoanticorpo de primeira linha por ser o de maior sensibilidade e estar amplamente disponível. Quanto maior o seu título, maior a chance de DC e maior a lesão duodenal. Títulos maiores que 5 vezes o limite superior da normalidade (LSN) têm um alto valor preditivo positivo.
Devido à possível associação da doença celíaca com a deficiência de IgA, a coleta da anti-tTG IgA deve ser realizada preferencialmente associada à dosagem de IgA total (especialmente nos pacientes com alta probabilidade da doença). Outra opção é associar a pesquisa de um autoanticorpo da classe IgG.
A antigliadina deaminada ou desaminada é um autoanticorpo contra a gliadina que entrou em contato com a enzima transglutaminase tecidual e sofreu o processo de desaminação (liberação do seu grupo amina). A associação da anti-tTG IgA à antigliadina deaminada IgG tem mostrado a melhor performance (sensibilidade e especificidade) para o diagnóstico da DC, mas a pesquisa deste autoanticorpo é mais cara e pouco disponível em nosso meio atualmente. Desta forma, uma boa opção, é a associação com a antitransglutaminase IgG, por exemplo.
O anticorpo antiendomísio IgA é o anticorpo com melhor especificidade (aproximadamente 100%) e por isso tem um importante papel de confirmação diagnóstica (especialmente nos pacientes com anti-tTG IgA com títulos menores que 2 vezes o LSN).
Performance dos testes sorológicos
A performance dos testes sorológicos na prática clínica é pior que em muitos dos grandes trials, pois geralmente os estudos são realizados em população com alta prevalência de DC. Além disso, também é importante lembrar que a performance dependem da manutenção da dieta com glúten. Cerca de 80% dos pacientes negativam os auto-anticorpos em 6 a 12 meses e mais de 90% em 5 anos. Pacientes fracamente positivos podem negativar seus autoanticorpos em poucas semanas de dieta. É pouco frequente que esses autoanticorpos não se normalizem a longo prazo com a dieta sem glúten. Se isso acontecer, é preciso descartar que o consumo de glúten não esteja acontecendo de forma inconsciente.
Na última década , estão sendo realizados muitos estudos com POCTs (point-of-care tests). São testes rápidos que podem ser usados tanto no setor de endoscopia quanto no consultório. Uma metanálise publicada em 2019, encontrou sensibilidade e especificidade de 94 e 94,4% respectivamente, levando em consideração a histologia como gold standard. Apesar desses resultados mostrando alta sensibilidade e especificidade, devido à grande variedade dos trabalhos realizados e resultados conflitantes, ainda se sugere mais estudos antes de usá-los na prática clínica. Por enquanto, o uso dos POCTs ainda deve ficar reservado para locais com acesso limitado a laboratórios.
Também estão sendo realizados estudos com pesquisa de autoanticorpos na saliva para rastreamento em crianças com suspeita de DC. Apesar dos resultados serem favoráveis, mostrando uma opção não invasiva, barata e reprodutível, as evidências até o momento ainda não são suficientes para recomendar o seu uso.
Já a detecção de autoanticorpos nas fezes não parece ser útil no rastreamento da doença, com trabalho mostrando sensibilidade de apenas 10%.
Visto que os autoanticorpos na DC são produzidos no próprio intestino delgado, estão sendo realizados trabalhos com pesquisa de autoanticorpos no sobrenadante da biópsia duodenal. Essa pesquisa parece ter sua importância principalmente no diagnóstico de pacientes em fases iniciais da doença, quando os autoanticorpos séricos ainda podem estar negativos. Mas ainda são necessários mais estudos para confirmar seu papel na prática clínica.
Conclusão
Os autoanticorpos são exames de extrema relevância para o diagnóstico da DC. Porém, não há um algoritmo único para a definição de qual autoanticorpo solicitar. Além de conhecer a sensibilidade e especificidade de cada um deles, é preciso avaliar a probabilidade pré-teste da doença em cada paciente e a acessibilidade aos diferentes exames disponíveis para, assim, definir a melhor estratégia.
Referências
- Green P, Stavropoulos S, Panagi SG, Goldstein S. Characteristics of adult celiac disease in the USA: results of a national survey. Am J Gastroenterol 2001;96:126– 131.
- Sanders DS. Changing face of adult coeliac disease: experience of a single university hospital in South Yorkshire. Postgrad Med J 2002;78(915):31–33.
- Al-Toma A , Volta U, Auricchio R, Castillejo G, Sanders D, Cellier C, Mulder C, Lundin K. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J . 2019;7(5):583-613.
- Singh P, Arora A, Strand T, Leffler D, Mäki M, Kelly C, Ahuja V, Makharia G. Diagnostic Accuracy of Point of Care Tests for Diagnosing Celiac Disease: A Systematic Review and Meta-Analysis. J Clin Gastroenterol 2019;53(7):535-542.
- De Leo L, Bramuzzo M, Ziberna F, Villanacci V, Martelossi S, Di Leo G, Zanchi C, Giudici F, Pandullo M, Riznik P, Di Mascio A, Ventura A, Not T. Diagnostic accuracy and applicability of intestinal auto-antibodies in the wide clinical spectrum of coeliac disease. EBioMedicine . 2020 Jan;51:102567
Como citar este artigo
Vilela E. O papel dos autoanticorpos no diagnóstico da doença celíaca. Gastropedia 2023, Vol 1. Disponível em: https://gastropedia.pub/pt/gastroenterologia/o-papel-dos-autoanticorpos-no-diagnostico-da-doenca-celiaca