Prevenindo novos episódios de diverticulite aguda: quando tratar clinicamente e quando operar?
Introdução
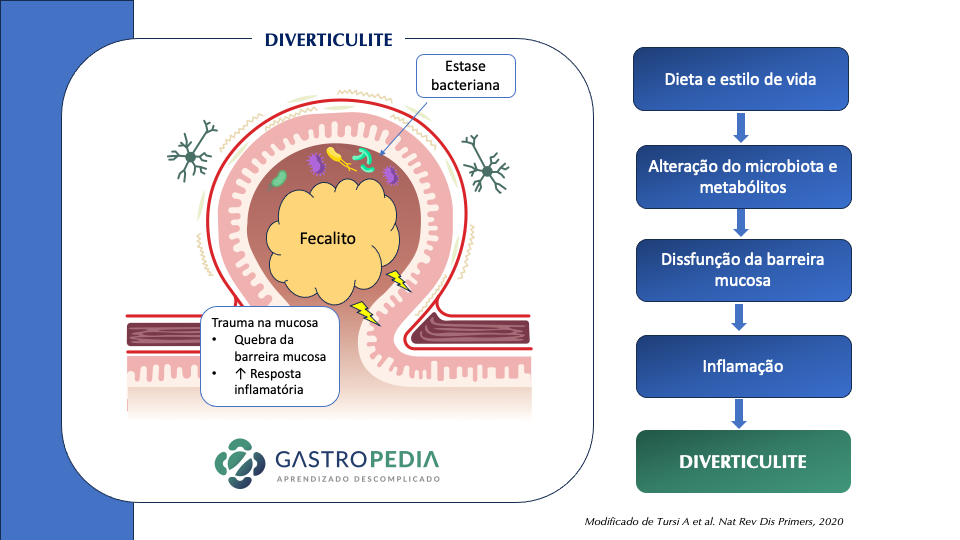
A diverticulite aguda é um problema gastrointestinal comum e recorrente que se caracteriza pela inflamação de um ou mais divertículos no cólon. Ela pode ocorrer tanto em formas leves quanto graves, podendo causar complicações como fístulas, estenoses e perfurações intestinais. Estudos mostram que o risco de recorrência varia de 20% a 40% e que frequentemente a recorrência acontece nos primeiros 12 meses após o episódio inicial. Desta forma, é importante discutirmos as abordagens de prevenção secundária e indicar quando é apropriado recorrer à cirurgia.
Se quiser saber mais sobre a fisiopatologia da diverticulite aguda e outras compicações da doença diverticular, confira esse post: Doença diverticular do cólon: epidemiologia e fisiopatologia
Se quiser saber mais sobre o tratamento da diverticulite aguda, confira esse post: Tratamento da Diverticulite Aguda
Intervenções Dietéticas
Fibras Alimentares
A abordagem alimentar é frequentemente considerada a primeira linha de ação na prevenção de novos episódios. As diretrizes da American Gastroenterological Association (AGA) sugerem uma dieta rica em fibras para pacientes com histórico de diverticulite aguda [1]. No entanto, a qualidade da evidência por trás dessa recomendação é baixa. Alguns estudos mostram que a dieta rica em fibras não é eficaz na prevenção de episódios recorrentes ou no tratamento de sintomas gastrointestinais recorrentes em comparação com uma dieta padrão ou pobre em fibras.
Probióticos
Os probióticos são outra intervenção dietética em potencial, embora a falta de evidência sólida impeça sua recomendação para a prevenção secundária de diverticulite. Até o momento, os estudos disponíveis não forneceram dados convincentes sobre sua eficácia.
Terapias Farmacológicas
Mesalazina
A mesalazina, um anti-inflamatório não esteroide, foi extensivamente estudada para sua eficácia na prevenção de episódios recorrentes de diverticulite. Uma meta-análise envolvendo 2.461 pacientes não conseguiu demonstrar uma redução significativa nas taxas de recorrência em comparação com um placebo. No entanto, um estudo de menor escala (DIVA), apontou que a mesalazina poderia ter efeitos benéficos na minimização da gravidade dos sintomas e aceleração da recuperação [3].
Rifaximina
Outra opção terapêutica é a rifaximina, um antibiótico com baixa absorção. Alguns estudos mostraram que a rifaximina, quando usada em conjunto com suplementos de fibra, conseguiu reduzir significativamente o risco de recorrência. A associação de rifaximina com mesalazina parece ter melhor resultado do que a rifaximina sozinha (taxa de recorrência 2,7% vs 13,0%), sugerindo uma potencial sinergia entre as duas drogas.
Tratamento Cirúrgico
A abordagem para a cirurgia eletiva em pacientes com diverticulite aguda tem evoluído ao longo do tempo. Anteriormente, a cirurgia era recomendada principalmente após episódios recorrentes e complicados, como obstrução e formação de fístulas, especialmente após duas crises que necessitavam de hospitalização. No entanto, tanto as diretrizes da ASCRS como alguns estudos recentes, sugerem uma abordagem mais individualizada [6].
O número de episódios já não é mais o único critério para a decisão cirúrgica. Idade, condições médicas coexistentes, gravidade do episódio e sintomas persistentes também devem ser considerados. Esta mudança ocorre porque a maioria dos episódios recorrentes apresenta um curso benigno e somente uma minoria (5%) requer cirurgia urgente. Estes episódios recorrentes parecem apresentar menor risco de perfuração, talvez pela formação de aderências causadas pela inflamação pregressa.
É importante notar que, apesar da morbidade pós-operatória (10-15%) e do risco residual de recorrência da doença, estudos como o ensaio DIRECT demonstraram que a qualidade de vida melhora significativamente após a cirurgia em comparação com o manejo conservador [5]. No entanto, o manejo conservador resulta em mais reinternações devido à recorrência da doença.
A colectomia laparoscópica é o método cirúrgico recomendado, dadas suas vantagens em termos de menor morbidade e recuperação mais rápida. As principais indicações para a cirurgia incluem estenose, fístulas, hemorragia diverticular recorrente, pacientes jovens, pacientes imunossuprimidos e a impossibilidade de excluir carcinoma. Idealmente deve-se aguardar pelo menos 6 semanas após o episódio de agudização para realizar a cirurgia eletiva.
Por fim, é fundamental a discussão multidisciplinar para uma tomada de decisão informada, levando em consideração o perfil de risco cirúrgico, a necessidade de imunossupressão e a preferência do paciente.
Conclusão
A abordagem terapêutica para prevenir novos episódios de diverticulite aguda deve ser individualizada, considerando a gravidade e a frequência dos sintomas, o perfil de risco cirúrgico e as preferências do paciente. Novas pesquisas são necessárias para solidificar as melhores práticas em prevenção secundária, incluindo a eficácia de diferentes regimes farmacológicos e abordagens cirúrgicas.
Referências
- Stollman N et al. American Gastroenterological Association Institute Guideline on the Management of Acute Diverticulitis. Gastroenterology 149, 1944–1949 (2015). [PubMed: 26453777]
- Khan RMA, Ali B, Hajibandeh S & Hajibandeh S Effect of mesalazine on recurrence of diverticulitis in patients with symptomatic uncomplicated diverticular disease: a meta-analysis with trial sequential analysis of randomized controlled trials. Colorectal Disease 20, 469–478 (2018). [PubMed: 29520987]
- Stollman N, Magowan S, Shanahan F, Quigley EMM & DIVA Investigator Group. A randomized controlled study of mesalamine after acute diverticulitis: results of the DIVA trial. J. Clin. Gastroenterol. 47, 621–629 (2013). [PubMed: 23426454]
- Tursi A, Brandimarte G & Daffinà R Long-term treatment with mesalazine and rifaximin versus rifaximin alone for patients with recurrent attacks of acute diverticulitis of colon. Digestive and Liver Disease 34, 510–515 (2002). [PubMed: 12236485]
- Bolkenstein HE, Consten ECJ, van der Palen J, van de Wall BJM, Broeders IAMJ, Bemelman WA, Lange JF, Boermeester MA, Draaisma WA; Dutch Diverticular Disease (3D) Collaborative Study Group. Long-term Outcome of Surgery Versus Conservative Management for Recurrent and Ongoing Complaints After an Episode of Diverticulitis: 5-year Follow-up Results of a Multicenter Randomized Controlled Trial (DIRECT-Trial). Ann Surg. 2019 Apr;269(4):612-620. doi: 10.1097/SLA.0000000000003033. PMID: 30247329.
- Hall J, Hardiman K, Lee S, Lightner A, Stocchi L, Paquette IM, Steele SR, Feingold DL; Prepared on behalf of the Clinical Practice Guidelines Committee of the American Society of Colon and Rectal Surgeons. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Treatment of Left-Sided Colonic Diverticulitis. Dis Colon Rectum. 2020 Jun;63(6):728-747.
- Tursi A, Scarpignato C, Strate LL, Lanas A, Kruis W, Lahat A, Danese S. Colonic diverticular disease. Nat Rev Dis Primers. 2020 Mar 26;6(1):20. doi: 10.1038/s41572-020-0153-5. PMID: 32218442
Como citar este artigo
Martins BC e Camargo MGM. Prevenindo Novos Episódios de Diverticulite Aguda: Quando Tratar Clinicamente e Quando Operar? 2023; vol 2. Disponível em: https://gastropedia.pub/pt/cirurgia/colorretal/prevenindo-novos-episodios-de-diverticulite-aguda-quando-tratar-clinicamente-e-quando-operar/