O que você precisa saber sobre Espasmo Esofágico Distal
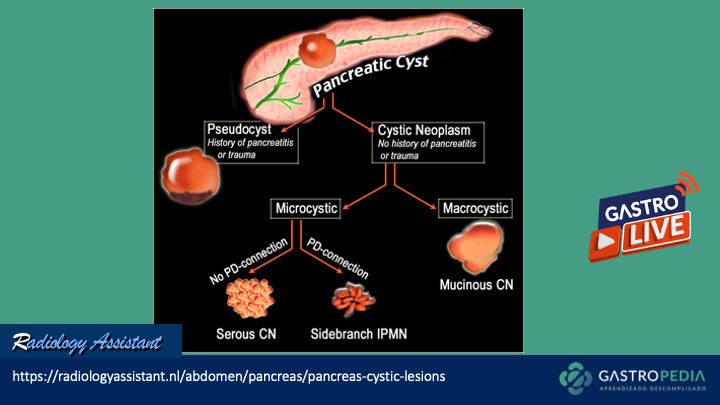
O que é?
É um raro distúrbio motor do esôfago caracterizado por contrações prematuras e rapidamente propagadas ou simultâneas (espásticas) em esôfago distal. Estudos estimam que a prevalência é em torno de 2% a 9% em pacientes com disfagia submetidos a testes de motilidade esofágica, sendo mais comum em mulheres com idade média de 60 anos.
Os sintomas do espasmo esofágico distal foram descritos clinicamente pela primeira vez pelo Dr. Osgood em 1889.[1] Ele descreveu seis pacientes com queixa de dor torácica súbita e disfagia durante a alimentação, com eventual sensação de passagem do alimento para o estômago. Em 1934, Moersch & Camp usaram o termo “espasmo difuso da parte inferior do esôfago” para descrever achados de contrações anormais em oito pacientes com dor torácica e disfagia.[2] Desde então, conforme avanços tecnológicos e melhorias nas técnicas de avaliação diagnóstica, sua definição passou por revisões ao longo do tempo.
Fisiopatologia
O espasmo esofágico distal surge por uma coordenação anormal da musculatura lisa esofágica, provavelmente decorrente de um desequilíbrio entre as vias inibitórias (óxido nítrico – NO) e excitatórias (colinérgicas). A depleção de NO em indivíduos controle, por exemplo, é capaz de induzir contrações esofágicas distais simultâneas, confirmando o papel de uma redução no tônus inibitório. Em contraste, a reposição de NO prolonga a latência distal em pacientes com espasmo.
Essa fisiopatologia parece ser compartilhada pela acalasia, onde a perda de neurônios mioentéricos inibitórios leva ao comprometimento do relaxamento do esfíncter esofágico inferior. Essa relação e alguns relatos de casos questionam se o espasmo poderia progredir para acalasia (principalmente tipo III). No entanto, nestes relatos a avaliação foi realizada primordialmente pela manometria convencional, que, por ter menos canais, pode subdiagnosticar a acalasia devido à possibilidade de pseudorelaxamento do esfíncter inferior do esôfago.
O espasmo esofágico pode estar associado à doença do refluxo gastroesofágico (DRGE). Em pacientes com espasmo, a DRGE foi detectada pela pHmetria ou endoscopia em 38% dos casos. Contudo, ainda não é bem definido a causalidade e o papel da terapia antissecretora nesta situação. O uso de opioides também claramente podem afetar a motilidade esofágica e, portanto, estas medicações devem ser descartadas neste contexto. Além disso, séries de caso demonstram que o espasmo pode estar associado a doenças psiquiátricas.
Como diagnosticar?
Quando suspeitar?
A apresentação clínica é heterogênea e não específica. As queixas mais comuns são disfagia (55%) e dor torácica não cardíaca (29%), mas também pode se apresentar com regurgitação, pirose, perda de peso, náuseas e vômitos. Tipicamente, os sintomas são intermitentes, durando de segundo a minutos, e podem ou não estar relacionados ou não a refeições.
Quais exames pedir?
- Endoscopia digestiva alta: Exame inicial fundamental para excluir diagnósticos diferenciais, tais como neoplasia, anéis e membranas, hérnia de hiato, esofagite eosinofílica. Embora a endoscopia não seja realizada para confirmar o espasmo em si, ela pode apresentar comportamentos sugestivos de distúrbio de motilidade, como contrações esofágicas distais espásticas, vigorosas e/ou descoordenadas, com retenção de saliva ou líquido no lúmen esofágico. Estas características, no entanto, podem ser facilmente ignoradas dada a natureza intermitente do espasmo esofágico.
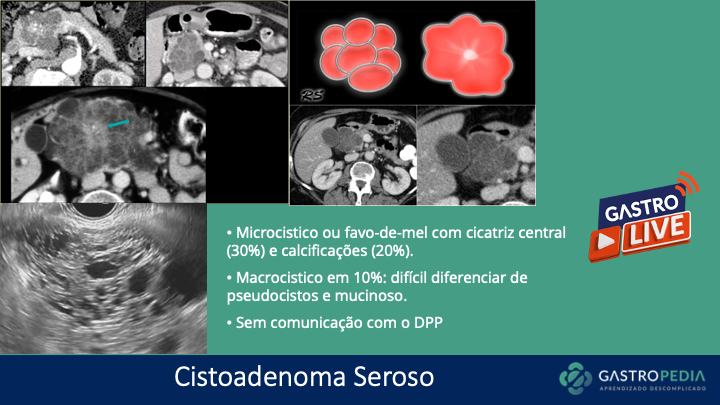
- Esofagograma baritado (Raio-X contrastado esôfago-estômago-duodeno, seriografia): É outro método diagnóstico adjuvante na disfagia. A aparência de “saca-rolhas” ou “rosário” é um achado clássico (Figura 1). Além disso, é capaz de determinar anormalidades anatômicas que podem estar associadas ao espasmo, tais como divertículo esofágico.
Figura 1. Vídeo com esofagograma evidenciando “esôfago em saca-rolha”, sugestivo de espasmo esofágico distal
- Manometria esofágica: É considerada o padrão-ouro para o diagnóstico. Na manometria de alta resolução, o ponto-chave para diagnóstico de espasmo passou a ser o tempo de latência distal (DL), que é definido como o tempo entre o relaxamento do esfíncter esofágico superior induzido pela deglutição e o ponto de desaceleração contrátil no esôfago distal, onde a velocidade de propagação diminui (Figura 2).
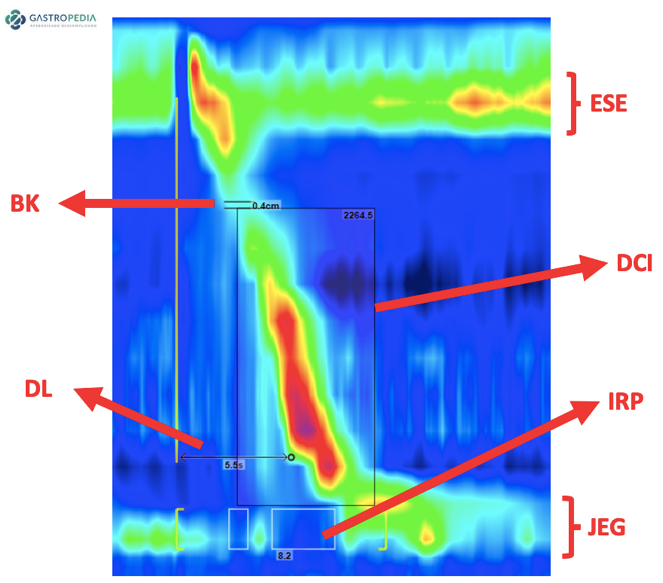
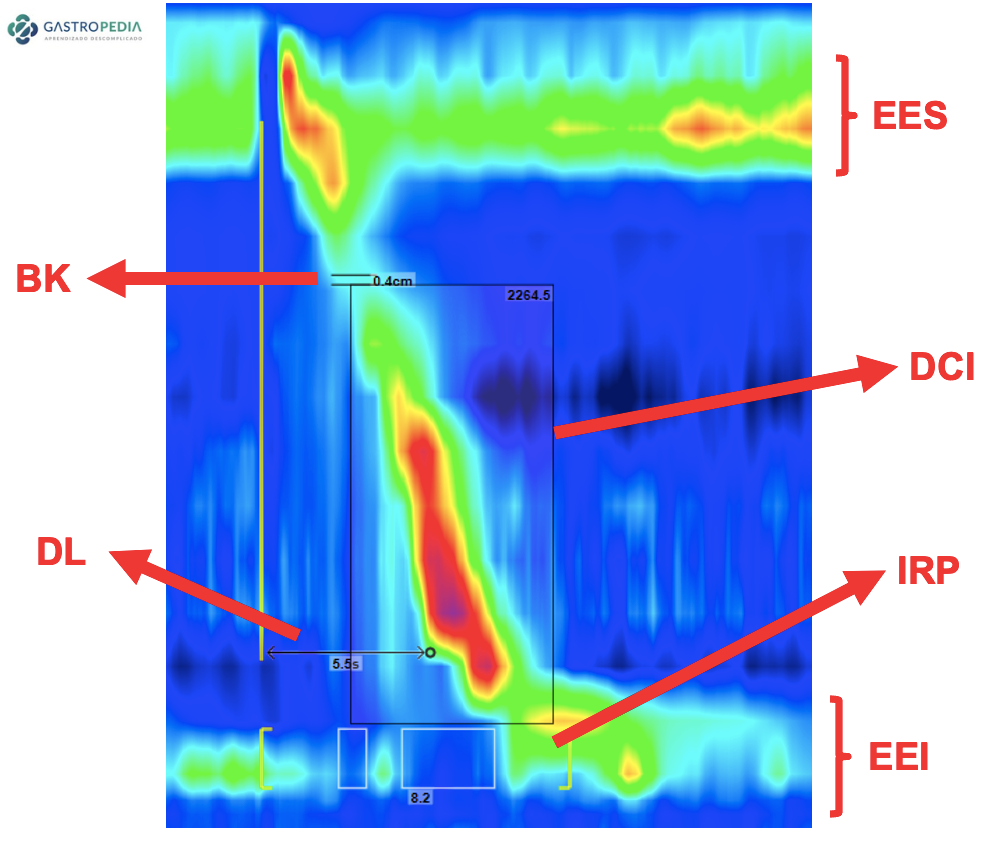
Uma contração com DL inferior a 4,5 segundos recebeu o termo “contração prematura” (Figura 3). Este valor de normalidade foi estabelecido para o sistema de estado sólido e é utilizado como referência para a Classificação de Chicago 4.0. Contudo, o sistema de manometria de alta resolução por perfusão ainda é o mais frequentemente usado no Brasil devido à sua maior durabilidade e ao menor custo do cateter e do sistema de transdução de pressão associado.
Buscando valores normativos para este sistema de perfusão em nossa população, trabalhos recentes realizaram manometria em voluntários assintomáticos e identificaram pontos de corte de 5,8 segundos[3] e 6,2 segundos[4], sugerindo que talvez estejamos subdiagnosticando o espasmo ao utilizar o valor de DL de 4,5 segundos em exames com o aparelho de perfusão. No entanto, é necessária a validação destes valores em pacientes para definir se eles realmente conseguem se correlacionar com os sintomas e com os diagnósticos propostos pela Classificação de Chicago 4.0.
Conforme a classificação de Chicago 4.0 (clique aqui), o espasmo esofágico distal é caracterizado pela presença de pelo menos 20% de contrações prematuras em esôfago distal, juntamente com uma pressão normal de relaxamento do esfíncter inferior. Para que o diagnóstico manométrico seja clinicamente relevante, é necessário que existam sintomas compatíveis.
Esta definição de Chicago mudou o foco da velocidade peristáltica para o DL como critério definidor do espasmo. Alguns autores destacam, contudo, que a presença de ondas simultâneas, mesmo com o DL normal, ainda poderia também ser considerada no diagnóstico de espasmo.

- FLIP: Exame ainda pouco disponível no Brasil, que discutimos melhor AQUI. Sua principal utilidade no contexto é avaliar o esfíncter inferior do esôfago e garantir que não há uma obstrução ao fluxo, especialmente porque o espasmo compartilha uma via fisiopatológica comum com a acalasia espástica.
Como tratar?
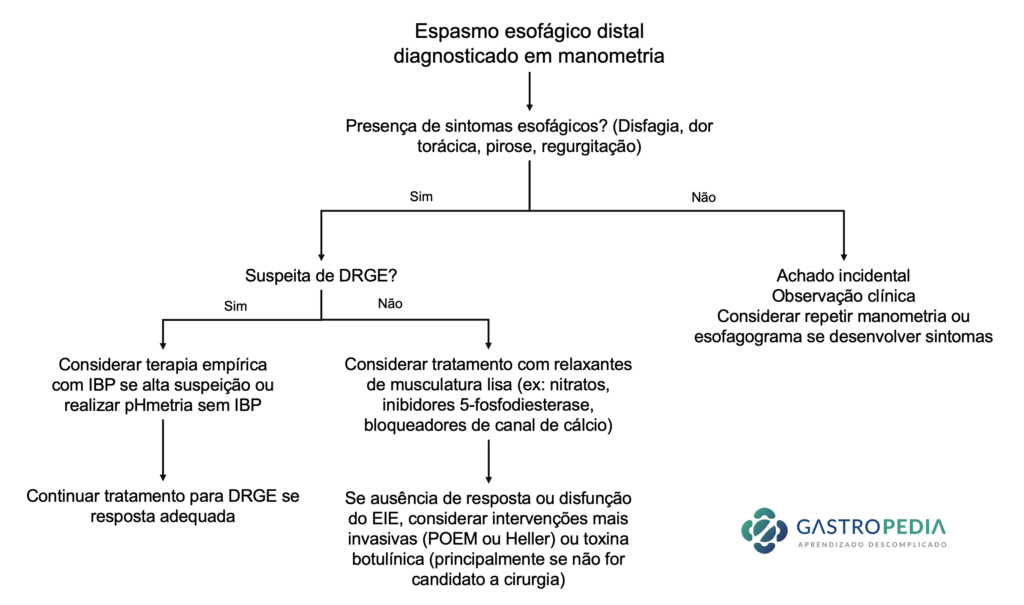
Devido à falta de ensaios clínicos suficientes e às manifestações heterogêneas, não há uma recomendação muito bem definida para o espasmo esofágico. As opções são:
- Tratamento medicamentoso
- Inibidores de bomba de prótons: Considerar naqueles pacientes com suspeita de DRGE;
- Relaxantes da musculatura lisa: nitratos (ex: dinitrato de isossorbida 5-10 mg sublingual 5 a 10 minutos antes de refeições no caso de disfagia ou sob demanda se dor torácica), inibidores de 5-fosfodiesterase (sildenafil), bloqueadores de canal de cálcio (diltiazem 180 a 240 mg/dia ou nifedipino 10-30 mg aproximadamente 10-15 minutos antes das refeições)
- Antidepressivos tricíclicos: Principalmente se a dor torácica for o sintoma principal. Ex: imipramina, trazodona, amitriptilina
- Tratamento endoscópico
- Miotomia endoscópica peroral (POEM)
- Toxina botulínica: 100 UI em cada quadrante do EIE / esôfago distal. A eficácia geralmente é limitada a 6-12 meses.
- Dilatação pneumática esofágica: considerar apenas se disfagia associada. Sucesso questionável.
- Tratamento cirúrgico: Miotomia cirúrgica laparoscópica (Heller).
A Figura 4 traz um fluxograma com a abordagem sugerida para o espasmo esofágico distal.
Conheça nosso curso Gastroenterologia do Consultório e saiba como lidar com as queixas mais comuns que encontramos no dia a dia
Referências
- Osgood H. A Peculiar Form of Œsorhagismus. Bost Med Surg J 1889;120:401–5. doi:10.1056/NEJM188904251201701.
- Moersch HJ, Camp JD. Diffuse Spasm of the Lower Part of the Esophagus. Ann Otol Rhinol Laryngol 1934;43:1165–73. doi:10.1177/000348943404300425.
- Domingues GR, Michelsohn NH, Viebig RG, Chinzon D, Nasi A, Andrade CG, et al. Normal values of esophageal high-resolution manometry: A Brazilian multicenter study. Arq Gastroenterol 2020;57:209–15. doi:10.1590/s0004-2803.202000000-40.
- da Silva RMB, Herbella FAM, Gualberto D. Normative values for a new water-perfused high resolution manometry system. Arq Gastroenterol 2018;55:30–4. doi:10.1590/s0004-2803.201800000-40.
- Zaher EA, Patel P, Atia G, Sigdel S. Distal Esophageal Spasm: An Updated Review. Cureus 2023;15:1–7. doi:10.7759/cureus.41504.
- Valdovinos-Díaz MA, Ortega AJ, Bashashati M, McCallum RW. Esophageal spasm and hypercontractile motility disorders. Handb. Gastrointest. Motil. Disord. Gut-Brain Interact., Elsevier; 2023, p. 47–58. doi:10.1016/B978-0-443-13911-6.00021-9.
- Akhtar TS, Nawaz A, Nisar G, Khan AR, Abbas S. Distal esophageal spasm (DES) can be achalasia in evolution: A case report. J Clin Images Med Case Reports 2023;4:2252. doi:www.doi.org/10.52768/2766-7820/2252.
- Gorti H, Samo S, Shahnavaz N, Qayed E. Distal esophageal spasm: Update on diagnosis and management inthe era of high-resolution manometry. World J Clin Cases 2020;8:1026–32.
- Khalaf M, Chowdhary S, Elias PS, Castell D. Distal Esophageal Spasm: A Review. Am J Med 2018;131:1034–40. doi:10.1016/j.amjmed.2018.02.031.
- Yadlapati R, Kahrilas PJ, Fox MR, Bredenoord AJ, Prakash Gyawali C, Roman S, et al. Esophageal motility disorders on high‐resolution manometry: Chicago classification version 4.0 ©. Neurogastroenterol Motil 2021;33. doi:10.1111/nmo.14058.
Como citar este artigo
Lages RB. O que você precisa saber sobre Espasmo Esofágico Distal Gastropedia 2023, vol. 2. Disponível em:
gastropedia.pub/pt/gastroenterologia/esofago/o-que-voce-precisa-saber-sobre-espasmo-esofagico-distal/