Tratamento de MASLD: Destaques do Novo Guideline da ALEH
Após a definição da nova nomenclatura (veja artigo) e com a disponibilidade e avanço dos estudos com novas drogas, o manejo da doença hepática esteatótica associada à disfunção metabólica (MASLD) ganhou novos contornos, culminando com a atualização da diretriz nacional e principais diretrizes internacionais entre 2024 e 2025. A mais recente delas foi a da Associação Latino-Americana para o Estudo do Fígado (ALEH). Abaixo, reunimos as principais recomendações no tratamento.
Tratamento não farmacológico
A base terapêutica da MASLD permanece sendo a intervenção no estilo de vida, reduzindo a esteatose hepática, prevenindo a progressão da doença e melhorando os desfechos gerais de saúde.
Intervenções na dieta e perda de peso
A dieta mediterrânea demonstrou benefícios consistentes na redução de esteatose, redução de eventos cardiovasculares e melhora da resistência insulínica, mesmo na ausência da perda de peso.
Outras orientações podem ser acrescentadas:
- Redução de bebidas adoçadas e alimentos processados;
- Redução de alimentos com alto teor de gordura saturada e trans;
- Ingestão de café, na ausência de contraindicações.
A perda de peso continua sendo o principal fator modificável, com metas distintas:
- 7–10% para pacientes com sobrepeso/obesidade;
- 3–5% em pacientes magros com MASLD.
Atividade física
Tanto a atividade física aeróbica quanto a de resistência demonstraram benefícios em MASLD. É recomendável:
- 150–300 minutos semanais de atividade física aeróbica em intensidade moderada ou 75–150 minutos em intensidade vigorosa;
- Atividades que visem fortalecimento muscular pelo menos duas vezes na semana.
Abstinência de álcool e cessação do tabagismo
- O consumo de álcool deve ser ativamente pesquisado e desencorajado;
- Para pacientes com fibrose significativa (≥ F2), a abstinência de álcool é recomendada.
- O tabagismo está associado à progressão da MASLD, ao aumento do risco de hepatocarcinoma e de eventos cardiovasculares, devendo ser cessado.
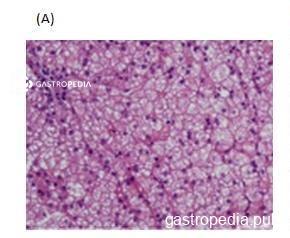
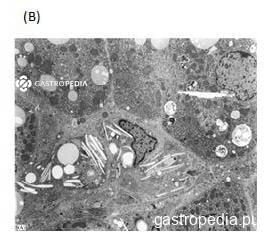
Tratamento farmacológico para MASH
O tratamento medicamentoso deve ser individualizado, baseado em fatores como presença de esteato-hepatite metabólica (MASH), grau de fibrose, diabetes tipo 2 (DM2) e obesidade. Até o momento, somente o resmetirom foi aprovado pelo FDA (Food and Drug Administration) como tratamento direcionado para MASLD.
O uso de terapias farmacológicas deve ser considerado em populações selecionadas, especialmente na presença de MASH com fibrose significativa (“at-risk MASH”).
Resmetirom
O resmetirom, agonista seletivo do receptor β do hormônio tireoidiano, foi aprovado pelo FDA nas doses de 80 e 100 mg/dia para pacientes com MASH e fibrose F2–F3. No estudo de fase 3 MAESTRO-NASH, atingiu os end-points primários, com resolução de MASH sem piora da fibrose, e melhora na fibrose em pelo menos um estágio, sem piora do NAFLD activity score. Ainda não possui previsão de disponibilidade no Brasil, além de apresentar elevado custo.
Incretinomiméticos
Semaglutida e liraglutida são agonistas do receptor GLP-1 com evidência relevante no tratamento da MASH. A semaglutida destacou-se com o estudo de fase 3 ESSENCE, que envolveu pacientes com MASH e fibrose F2-F3 (clique aqui para mais detalhes). Após 72 semanas, 62,9% dos que receberam 2,4 mg semanais obtiveram resolução da esteato-hepatite, comparado a 34,1% no grupo placebo. Também houve melhora de fibrose sem piora da inflamação em 37% dos tratados (vs. 22,5%). Já em cirrose compensada, a semaglutida não foi eficaz. A liraglutida também demonstrou benefício em estudo menor (fase 2), com doses entre 0,6 e 1,8 mg/dia.
A tirzepatida, recentemente aprovada no Brasil para DM2, é agonista dual de GIP e GLP-1. No estudo SYNERGY-NASH, com 190 pacientes com MASH e fibrose F2-F3, houve resolução significativa da MASH em até 62% dos tratados (vs. 10% no placebo), além de melhora de fibrose em até 61% (vs. 30% no placebo).
Embora outras moléculas como survodutida e pemvidutida também apresentem resultados positivos em estudos de fase 2, essas ainda não estão disponíveis.
Outras terapias emergentes para MASH: promissoras, mas ainda distantes da prática clínica
Diversas novas medicações estão sendo investigadas para o tratamento da MASH, com abordagens que atuam em diferentes vias metabólicas, inflamatórias e fibrogênicas. No entanto, a maioria delas ainda está em fases iniciais de desenvolvimento ou não foi aprovada por agências regulatórias.
- Lanifibranor, um agonista pan-PPAR, demonstrou benefícios tanto na resolução da MASH quanto na regressão da fibrose em estudo de fase 2, e está em fase 3 com critérios histológicos rigorosos.
- Entre os agonistas do receptor farnesóide X, o ácido obeticólico foi inicialmente promissor na melhora histológica, mas efeitos adversos como prurido e dislipidemia, além de eficácia considerada modesta, levaram à não aprovação pela FDA e à descontinuação dos estudos.
- Análogos do fator de crescimento de fibroblastos, como efruxifermin e pegozafermin, seguem em fase de desenvolvimento, com resultados encorajadores em relação à melhora metabólica e redução de gordura hepática.
Medicações com outras indicações, mas com benefícios para MASH
Diversas terapias farmacológicas já disponíveis para outras indicações, têm mostrado benefício na abordagem de pacientes com MASLD/MASH, especialmente quando terapias específicas ainda não estão acessíveis. Abaixo, um resumo útil para a prática clínica:
- Vitamina E: Mostrou eficácia na melhora de MASH, como evidenciado no estudo PIVENS, que utilizou 800 UI/dia por 96 semanas. No entanto, seu impacto na fibrose é incerto e há preocupações com efeitos adversos, como AVC hemorrágico e câncer de próstata. Por isso, seu uso como primeira linha não é recomendado, podendo ser considerado em adultos com MASH e não diabéticos.
- Pioglitazona: Melhora histologia hepática e resistência à insulina. Contudo, efeitos adversos potenciais incluem ganho de peso, osteoporose em mulheres na pós-menopausa, piora da insuficiência cardíaca e risco controverso de câncer de bexiga. Esses efeitos adversos devem ser ponderados em relação à redução do risco de AVC, infarto do miocárdio não fatal e mortalidade por todas as causas associada ao uso da pioglitazona.
- Inibidores do Cotransportador Sódio-Glicose tipo 2 (p.ex. dapaglifozina, empaglifozina): Já aprovados para diabetes tipo 2, esses agentes têm benefício cardiovascular e renal. Estudos sugerem que reduzem a gordura hepática, mas ainda sem evidência consolidada em MASH.
- Metformina: Estudos iniciais sugerem que a metformina pode reduzir ALT e melhorar a sensibilidade à insulina, mas não há evidência de benefício histológico em MASH. Deve ser evitada em cirrose descompensada ou insuficiência renal.
- Estatinas: Além do controle lipídico, têm efeitos anti-inflamatórios e antifibróticos. Estudos observacionais associam seu uso à menor mortalidade e progressão da rigidez hepática. São seguras na MASLD e não aumentam o risco de lesão hepática grave.
- AAS (ácido acetilsalicílico): Em baixa dose (81 mg/dia), demonstrou redução de gordura hepática em pacientes com MASLD, provavelmente por efeitos na redução da inflamação hepática, estresse oxidativo e resistência insulínica. São necessários estudos maiores e com seguimento mais longo para confirmar a eficácia e segurança da aspirina no tratamento da MASLD além do controle do risco cardiovascular.
Cirurgia bariátrica
A cirurgia bariátrica é opção eficaz para pacientes com obesidade e MASLD que não obtiveram perda de peso ou melhora metabólica com mudanças no estilo de vida e tratamento clínico. Além de promover perda ponderal substancial, reduz significativamente a esteatose hepática, inflamação, fibrose e risco cardiovascular.
A seleção criteriosa dos pacientes é essencial, especialmente em casos de cirrose compensada, que podem demandar condutas específicas ou abordagens alternativas. A cirurgia deve ser considerada dentro de um modelo multidisciplinar e, quando bem indicada, impacta positivamente não só a obesidade, mas também a progressão da doença hepática.
Referências
- Diaz LA, Arab JP, Idalsoaga F, Perelli J, Vega J, Dirchwolf M, Carreño J, Samith B, Valério C, Moreira RO, Acevedo M, Brahm J, Hernández N, Gadano A, Oliveira CP, Arrese M, Castro-Narro G, Pessoa MG. Updated recommendations for the management of metabolic dysfunction-associated steatotic liver disease (MASLD) by the Latin American working group. Ann Hepatol. 2025 Mar 13:101903. doi: 10.1016/j.aohep.2025.101903. Epub ahead of print. PMID: 40089151.
Como citar este artigo
Recuero AM, Tratamento de MASLD: Destaques do Novo Guideline da ALEH Gastropedia 2025, Vol.1. Disponível em: https://gastropedia.pub/pt/gastroenterologia/figado/tratamento-de-masld-destaques-do-novo-guideline-da-aleh/