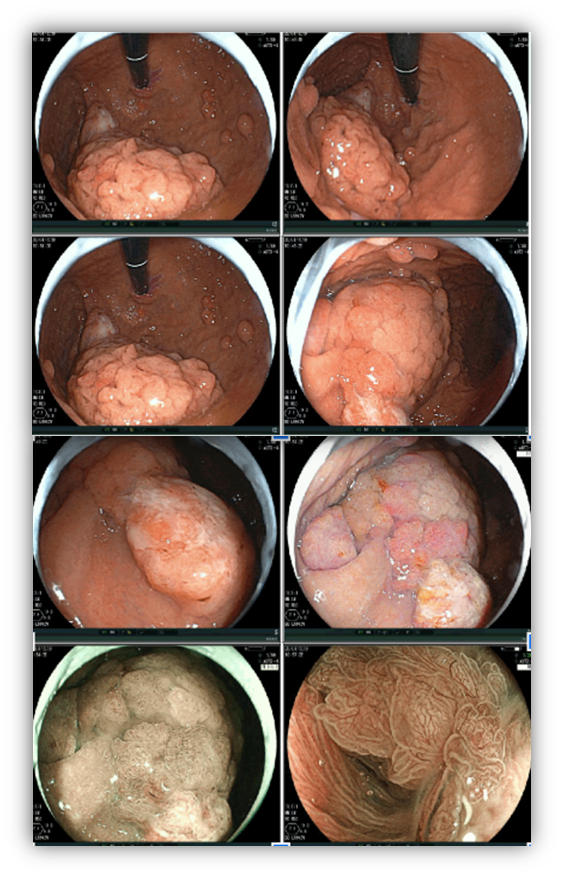
Imunodeficiência Comum Variável e Câncer Gástrico
Fatores de risco comumente relacionados com o desenvolvimento do câncer gástrico (CG) incluem a infecção crônica pelo Helicobacter pylori (H. pylori), baixa ingestão de frutas e vegetais, consumo de sal elevado, tabagismo e consumo de álcool.
Outro fator de risco conhecido, porém pouco citado, é a presença de Imunodeficiências primárias (IDP), que além de aumentar o risco de desenvolvimento de CG ocasiona sua manifestação em idades mais precoces do que na população geral.
As IDP são um conjunto de doenças que abrangem mais de 300 defeitos inatos da imunidade, sendo a maioria de causa desconhecida. Portadores de IDP apresentam risco aumentado de infecções recorrentes e crônicas, doenças autoimunes e neoplasias ao longo da vida.
Seguido das infecções, a ocorrência de neoplasias é a segunda causa mais comum de morte nessa população. Estima-se que 4 a 25% dos portadores de IDP desenvolverão alguma neoplasia. Especificamente, o risco de desenvolver CG é em torno de 3 a 4 vezes maior nessa população.
Com relação aos pacientes com IDP, a presença de distúrbios gastrointestinais é bastante frequente, podendo ocorrer em 5% a 50% dos casos. Isto ocorre, em parte, porque o intestino é o maior órgão linfóide do corpo humano, contendo a maioria dos linfócitos e produzindo grandes quantidades de Imunoglobulinas. Manifestações gastrointestinais podem ser relacionadas com infecção, inflamação, doenças autoimunes e neoplasias.
Imunodeficiência comum variável (IDCV)
A imunodeficiência comum variável (IDCV) é a forma mais comum das IDP, e sua prevalência é estimada em 1 a cada 25.000 a 50.000 pessoas.
Sua patogênese ainda não foi totalmente esclarecida, entretanto mutações de diversos genes relacionados com o desenvolvimento de células B em plasmócitos produtores de imunoglobulinas e células B de memória foram descritos.
Indivíduos afetados comumente apresentam infecções bacterianas recorrentes do trato respiratório superior e inferior, doenças autoimunes, doença infiltrativa granulomatosa e neoplasias. Os tumores mais comuns são o linfoma, câncer gástrico e o câncer de mama.
O diagnóstico é baseado na redução significativa dos níveis séricos de IgG, IgA e/ou IgM, além da produção reduzida de anticorpos após a aplicação de vacinas. A maioria dos pacientes é diagnosticado entre os 20 e 40 anos, e o tratamento consiste na administração mensal de imunoglobulina.
IDCV e Câncer Gástrico
O aumento do risco de CG em pacientes com IDCV é variável de acordo com a própria taxa de incidência de CG em pacientes sem IDCV no país avaliado. Nesse sentido, um estudo escandinavo estimou um risco aumentado em 10 vezes, enquanto um estudo australiano demonstrou um risco aumentado de 7,23 vezes.
Embora não haja evidência conclusiva, o mecanismo mais aceito para o aumento do risco do CG na presença de IDCV deve-se a redução da produção de IgA gástrica e de ácido clorídrico ― fatores estes que propiciam gastrite crônica e facilitam a colonização por H. pylori, desencadeando o processo de carcinogênese. Esse mecanismo é suportado pela constatação de que pacientes com anemia perniciosa, que também apresentam acloridria e gastrite crônica, têm um risco três vezes maior de desenvolver CG. A diminuição da reposta imune local também é um fator que pode desempenhar um papel no desenvolvimento neoplásico, devido a menor presença de células B na mucosa gástrica de pacientes com IDCV.
A idade do diagnóstico do câncer em pacientes com IDCV costuma ocorrer em idade mais precoce, em média 15 anos mais cedo do que na população geral.
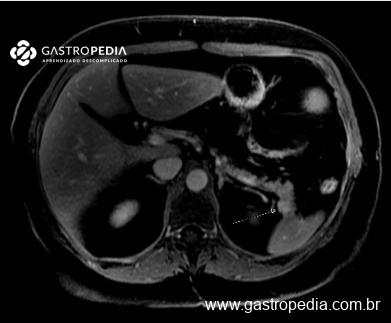
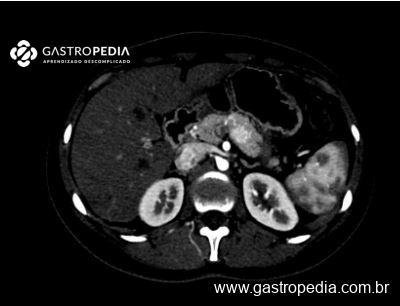
Em relação ao diagnóstico histológico do tumor, o tipo Intestinal de Lauren costuma ser o mais frequente, apresentando grau de diferenciação moderado ou pouco diferenciado. Além disso, pangastrite atrófica com pouca presença de plasmócitos, agregados linfóides nodulares e atividade apoptótica costumam estar presentes devido ao quadro de gastrite autoimune associada.
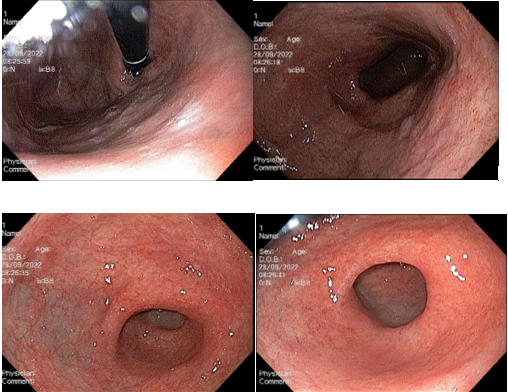
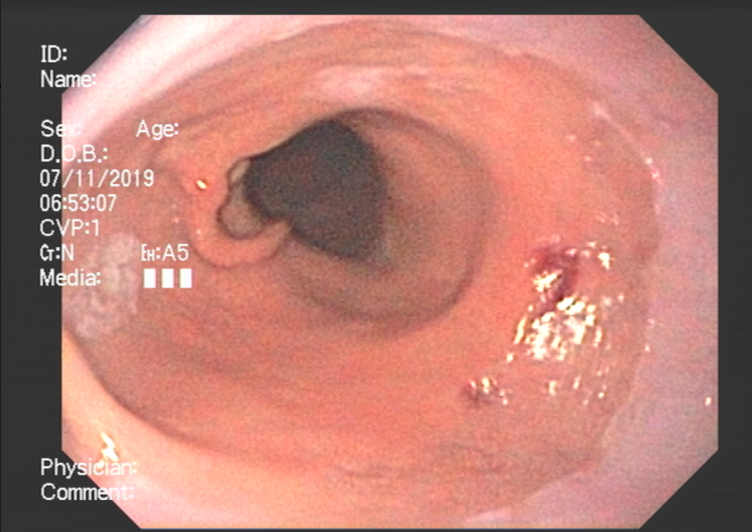
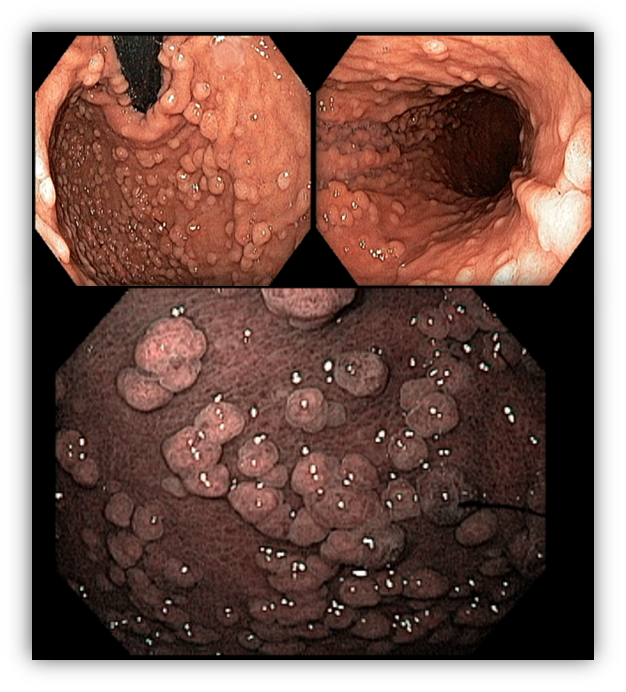
Frente às evidências de maior risco de desenvolvimento de CG, é importante que os pacientes com IDCV sejam incluídos em programas de rastreamento. Dados holandeses demonstraram que há uma incidência alta de lesões histológicas e/ou endoscópicas pré-malignas em pacientes com IDCV, tais como gastrite atrófica, metaplasia intestinal e displasia, mesmo naqueles assintomáticos. Até 88% dos pacientes com IDCV sem história gastrointestinal prévia podem apresentar lesões pré-malignas na endoscopia. As taxas de progressão dessas lesões para o CG variam de 0–1,8% por ano na gastrite atrófica; de 0–10% por ano para metaplasia intestinal; e de 0–73% por ano quando já existe presença de displasia.
Intervalos entre os exames de seguimento normalmente empregados podem não ser apropriados para pacientes com IDCV, uma vez que o desenvolvimento do CG pode ocorrer de modo mais rápido. De fato, não existe um protocolo de rastreamento padronizado, e seu emprego deve levar em consideração a incidência de CG regional. Paciente com IDCV podem desenvolver câncer de alto grau de 12 a 14 meses após uma endoscopia sem sinais de displasia. Isso justifica a proposta de no mínimo realizar EDA em todos os pacientes com IDCV no momento do diagnóstico; repeti-la a cada 24 meses em pacientes com histologia normal; a cada 12 meses em pacientes com gastrite atrófica ou metaplasia intestinal; e a cada 6 meses em pacientes com displasia. Recomenda-se ainda a erradicação do H. pylori de rotina.
Tratamento
Não existem protocolos específicos para o tratamento do câncer em pacientes com IDCV. Uma vez realizado o diagnóstico de CG, estes pacientes devem ser submetidos ao tratamento padrão – o mesmo oferecido à população imunocompetente.
Suporte nutricional pré-operatório e administração de Imunoglobulina são medidas recomendadas. Pacientes com IDCV podem receber os mesmos protocolos de quimioterapia utilizados em pacientes imunocompetentes. Entretanto, protocolos de curta duração são preferíveis aos regimes de longa duração, com atenção especial ao controle de infecção. Quando possível, o regime de quimioterapia deve ser adaptado conforme os fatores de risco e tolerância individuais.
Referência
Krein P, Yogolare GG, Pereira MA, Grecco O, Barros MAMT, Dias AR, Marinho AKBB, Zilberstein B, Kokron CM, Ribeiro-Júnior U, Kalil J, Nahas SC, Ramos MFKP. Common variable immunodeficiency: an important but little-known risk factor for gastric cancer. Rev Col Bras Cir. 2021 Dec 15;48:e20213133. English, Portuguese. doi: 10.1590/0100-6991e-20213133. PMID: 34932733.
Como citar este artigo
Ramos MFKP. Imunodeficiência Comum Variável e Câncer Gástrico. Gastropedia 2023 vol. 1. Disponível em: https://gastropedia.pub/pt/gastroenterologia/strongimunodeficiencia-comum-variavel-e-cancer-gastrico/