Otimização dos resultados após cirurgias bariátricas e metabólicas
A obesidade e suas complicações estão se tornando cada vez mais prevalentes em todo o mundo. Diante desse cenário desafiador, é fundamental adotar abordagens multifacetadas e eficazes para prevenir e tratar essa condição de saúde pública. O crescente reconhecimento da obesidade como uma doença crônica e progressiva tem impulsionado avanços significativos no campo do tratamento.
Novos medicamentos antiobesidade têm demonstrado promissora eficácia no combate ao excesso de peso. No entanto, a personalização do tratamento é essencial, combinando diferentes estratégias para garantir que todos tenham acesso equitativo a opções terapêuticas eficazes.
Atualmente, a cirurgia bariátrica/metabólica é considerada a intervenção mais eficaz e duradoura para o tratamento da obesidade e suas complicações. Acredita-se que, quando bem indicado, o uso concomitante de medicamentos antiobesidade antes, durante ou após a cirurgia possa potencializar os resultados, otimizando desfechos em casos selecionados. No entanto, ainda há lacunas significativas de evidências científicas sólidas para orientar essas recomendações.
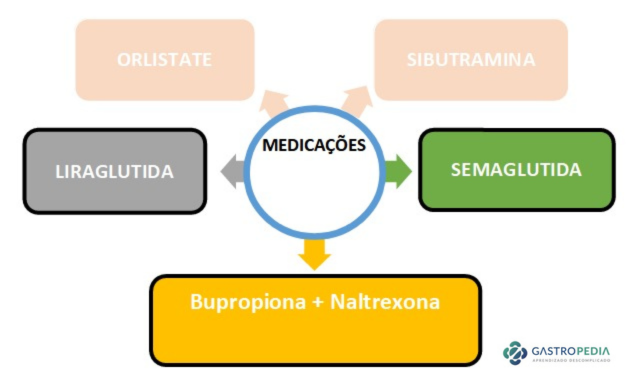
Opções para o tratamento farmacológico da obesidade disponíveis no Brasil:
- Sibutramina
- Orlistat
- Liraglutida (Saxenda)
- Semaglutida (Ozempic/Wegovy)
- Associação de Bupropiona com Naltrexona (Contrave)
Uso de medicamentos antiobesidade antes da cirurgia bariátrica/metabólica
A perda de peso antes da cirurgia pode melhorar os resultados durante e após o procedimento, mas seu impacto nas complicações pós-operatórias é limitado, especialmente com o uso de técnicas laparoscópicas por equipes experientes. A gestão de peso pré-operatória deveria se centrar mais na educação e modificações de comportamento do que na própria perda de peso.
Para quem se poderia considerar o uso de medicamentos antiobesidade no pré-operatório com o intuito de otimizar resultados cirúrgicos?
- Pessoas com obesidade grave e índice de massa corporal acima de 50 Kg/m2
- Pacientes com diabetes mellitus do tipo 2 para melhora do controle glicêmico
Pacientes com cirrose hepática, insuficiência cardíaca ou renal se beneficiariam da perda de peso pré-operatória, porém não existem estudos com medicações para perda de peso nessas populações.
A escolha da farmacoterapia deve ser individualizada dentro do que dispomos de opções. Estudos mostram que enquanto Orlistat apresenta uma perda discreta e pouco auxílio na perda pré-operatória, os medicamentos análogos de GLP-1 mostram grande eficácia em relação à perda de peso e controle glicêmico.
Recomendações para Suspensão de Medicamentos Antiobesidade no Pré-Operatório
Os medicamentos antiobesidade, especialmente os análogos do peptídeo semelhante ao glucagon -1 (GLP-1), são amplamente reconhecidos por sua eficácia na perda de peso e controle metabólico. No entanto, devido ao seu efeito de lentificar o esvaziamento gástrico, é importante considerar sua suspensão antes de procedimentos cirúrgicos.
De acordo com a Sociedade Americana de Anestesiologia, para os análogos de GLP-1 de uso diário, como a liraglutida, recomenda-se a manutenção do uso até o dia anterior à cirurgia. Por outro lado, para os análogos de GLP-1 de uso semanal, como a semaglutida, o uso deve ser interrompido até 7 dias antes do procedimento.
No Brasil, a Sociedade Brasileira de Diabetes (SBD) oferece diretrizes que recomendam interromper o uso da liraglutida 2 dias antes da cirurgia e da semaglutida (oral ou subcutânea) 21 dias antes. Para a dulaglutida, a recomendação é suspender 15 dias antes. Essas orientações baseiam-se na meia-vida dos medicamentos e na prática de suspender o uso com 3 meias-vidas de antecedência, embora haja escassez de estudos específicos.
A Sociedade Brasileira de Anestesiologia (SBA) concorda com as orientações da SBD.
Uso de medicamentos antiobesidade após a cirurgia bariátrica/metabólica
Para pacientes enfrentando perda de peso subótima ou reganho excessivo após a cirurgia, as opções de tratamento são limitadas. Reparos pós-cirúrgicos, conversões para procedimentos mais invasivos ou reintrodução de técnicas de manejo do estilo de vida são algumas alternativas. No entanto, tais procedimentos adicionais apresentam taxas de complicações mais elevadas. Nesse cenário, a farmacoterapia surge como uma alternativa potencialmente mais segura.
Atualmente, não há medicamentos aprovados especificamente para pacientes pós-cirurgia bariátrica com perda de peso insuficiente ou reganho de peso. Essa população é frequentemente excluída de grandes estudos. No entanto, evidências mostram que o uso off-label de medicamentos antiobesidade pode resultar em uma perda de peso significativa. Por exemplo, pacientes que receberam liraglutida 3.0 mg após a cirurgia apresentaram reduções notáveis no peso, sugerindo sua eficácia nesse contexto.
É importante considerar que diferentes tipos de cirurgia bariátrica podem influenciar a resposta ao tratamento medicamentoso. Enquanto algumas cirurgias aumentam os níveis de peptídeo semelhante ao glucagon-1 (GLP-1) e contribuem para a perda de peso, outras podem ter efeitos diferentes. Estudos mostraram que pacientes submetidos a gastrectomia vertical podem perder menos peso em comparação com outros procedimentos.
Por que e quando considerar estratégias combinadas?
Por que?:
- A probabilidade de recidiva do T2D após um período de remissão, associada a uma resposta de peso subótima e ganho de peso recorrente.
- A perda de peso total de mais de 15% após cirurgia bariátrica sustentada pode controlar ou interromper complicações do diabetes e reduzir a mortalidade.
- A progressão da doença crônica (obesidade e/ou diabetes mellitus tipo 2) pode exigir tratamentos mais intensivos, incluindo o uso adicional de medicamentos para manter ou melhorar o controle metabólico após a cirurgia.
Quando?:
- Recidiva do diabetes tipo 2 ou descontrole após cirurgia e/ou resposta subótima da perda de peso.
- Pacientes com índice de massa corporal inicial elevado, especialmente acima de 50 kg/m2, podem precisar iniciar o uso de medicamentos mais precocemente para evitar o reganho de peso.
Apesar do crescente interesse, há escassez de dados de ensaios clínicos randomizados (RCTs) sobre a combinação de fármacos antiobesidade e cirurgia bariátrica/metabólica.
Dentre os estudos clínicos relevantes:
- No estudo STAMPEDE, que comparou terapia médica intensiva isolada com cirurgia mais tratamento médico, pacientes submetidos à cirurgia, além do melhor tratamento médico, alcançaram uma perda de peso mais significativa após um acompanhamento de 5 anos, destacando a eficácia da combinação de medicamentos com cirurgia.
O estudo Microvascular Outcomes after Metabolic Surgery, um ensaio clínico randomizado que compara a melhor terapia clínica com a cirurgia de bypass gástrico em Y-de-Roux (RYGB) em pacientes com diabetes tipo 2 (T2D) e microalbuminúria estabelecida, tem como objetivo examinar a remissão da albuminúria, a perda de peso, o controle glicêmico, entre outros desfechos secundários.
Quanto à escolha de medicamentos, a terapia com agonistas do receptor de GLP1 demonstrou eficácia e segurança, conforme evidenciado pelo estudo GRAVITAS, que destacou melhorias no controle glicêmico e perda de peso em pacientes com diabetes tipo 2 após cirurgia bariátrica.
Referências:
- Nor Hanipah Z, Nasr EC, Bucak E, Schauer PR, Aminian A, Brethauer SA, et al. Efficacy of adjuvant weight loss medication after bariatric surgery. Surgery for Obesity and Related Diseases. 2018 Jan;14(1):93–8. Miras AD, Pérez-Pevida B, Aldhwayan M, Kamocka A,
- McGlone ER, Al-Najim W, et al. Adjunctive liraglutide treatment in patients with persistent or recurrent type 2 diabetes after metabolic surgery (GRAVITAS): a randomised, double-blind, placebo-controlled trial. The Lancet Diabetes & Endocrinology. 2019 Jul;7(7):549–59.
- Tewksbury C, Williams NN, Dumon KR, Sarwer DB. Preoperative Medical Weight Management in Bariatric Surgery: a Review and Reconsideration. OBES SURG. 2017 Jan;27(1):208–14.
- Malone M, Alger-Mayer SA, Lindstrom J. Use of Orlistat 60 mg in the Management of Weight Loss before Bariatric Surgery. Ann Pharmacother. 2012 Jun;46(6):779–84.
- Cohen RV, Pereira TV, Aboud CM, Petry TBZ, Lopes Correa JL, Schiavon CA, et al. Effect of Gastric Bypass vs Best Medical Treatment on Early-Stage Chronic Kidney Disease in Patients With Type 2 Diabetes and Obesity: A Randomized Clinical Trial. JAMA Surg. 2020 Aug 19;155(8):e200420.
- Mok J, Adeleke MO, Brown A, Magee CG, Firman C, Makahamadze C, et al. Safety and Efficacy of Liraglutide, 3.0 mg, Once Daily vs Placebo in Patients With Poor Weight Loss Following Metabolic Surgery: The BARI-OPTIMISE Randomized Clinical Trial. JAMA Surg [Internet]. 2023 Jul 26 [cited 2023 Aug 6]; Available from: https://jamanetwork.com/journals/jamasurgery/fullarticle/2807724
Como citar este artigo
Cohen RV, Silveira LP. Otimização dos resultados após cirurgias bariátricas e metabólicas Gastropedia 2024, Vol 2. Disponível em: https://gastropedia.pub/pt/cirurgia/otimizacao-dos-resultados-apos-cirurgias-bariatricas-e-metabolicas