Reconstrução de parede abdominal no paciente portador de hérnia ventral complexa: os impactos do planejamento cirúrgico
Autores: Pedro Amaral, Eduardo Dias, Jessica Macret, João Paulo Carvalho, Luca Pivetta, Sergio Roll
As hérnias da parede abdominal representam um conjunto de doenças bastante prevalentes na população. Aproximadamente 27% da população irá receber algum diagnóstico de hérnia ao longo da vida e o tratamento será majoritariamente cirúrgico.
Nos últimos 20 anos, a cirurgia de parede abdominal apresentou evidente desenvolvimento, quer seja nos tratamentos convencionais – que ainda representam a maioria dos procedimentos – quer seja na modalidade minimamente invasiva, passando pela videolaparoscopia e, mais recentemente, a robótica. Desenvolveram-se amplamente, também, os materiais utilizados para este fim, como por exemplo as telas cirúrgicas, os fixadores e até os fios de sutura. Estes, passaram a ser designados com tecnologias próprias para a cirurgia da parede abdominal, produzidos com propriedades de absorção específica para cada tecido ou conformação farpada. A primeira reduz as deiscências e a segunda proporciona sutura unidirecional, que distribui a tensão e facilita o fechamento.
A grande maioria das hérnias serão curadas com êxito através de uma técnica cirúrgica bem aplicada e respeitando-se as orientações de pós-operatório. Isso é fato. Mas gostaríamos de chamar a atenção para um subgrupo que nem sempre apresenta fácil resolução, requerem com frequência cirurgias tecnicamente exigentes e podem ser acompanhadas de um período pós-operatório turbulento.
Em linhas gerais, se quisermos criar um estereótipo da hérnia difícil, ele certamente abrangerá um diâmetro herniário largo, contendo vísceras deslocadas da cavidade abdominal para o seu interior, terá musculatura hipotrófica ao seu redor, por vezes apresentando recidivas de tentativas frustradas de correção, em um paciente que não goza de boa condição clínica.
As taxas reportadas de recidiva em grupos complexos costumam variar de 24 a 43% e são consideradas elevadas. As razões para isso são multifatoriais, mas devem-se, em parte, às percepções errôneas de que estes pacientes não representam um desafio clínico.
O impacto na utilização de recursos e custos de saúde passaram a ser mais considerados atualmente. Neste grupo, observa-se um tempo de internação maior, cuidados intensivos podem ser necessários, os materiais utilizados são mais caros e o reparo cirúrgico pode não ser duradouro, fazendo com que os procedimentos sejam repetidos inúmeras vezes de forma redundante no mesmo paciente. No Brasil, houve um aumento de 90 milhões de reais na cirurgia da parede abdominal em 2024, comparado com o ano anterior, o que impactou em 13% a mais de pacientes operados em um ano. Nos Estados Unidos, custo anual total chegou a $ 9,7 bilhões de dólares em 2023, o que ultrapassa o valor que se gasta com cirurgia oncológica por exemplo.
Se, o cirurgião que está na linha de frente estiver treinado para perceber algumas armadilhas, ele se esquivará de intempéries do pós-operatório e o seu paciente terá otimizada a sua chance de um reparo único, longevo e que impactará satisfatoriamente na sua qualidade de vida. É disso que vamos falar aqui embaixo.
Quem é o paciente portador de hérnia complexa?
As hérnias complexas podem ser assim denominadas quando se encaixam na classificação proposta por Slater et al que leva em consideração 4 critérios.
- Tamanho e localização: sendo atribuído critério de complexidade às hérnias maiores de 10cm, fora da linha média e próximas a proeminências ósseas, que dificultam a sobreposição da tela.
- Fatores de risco e comorbidades: sobretudo as descontroladas, como por exemplo os pacientes tossidores crônicos que repetidamente aumentam a pressão intra-abdominal e os diabéticos mal controlados, com Hb-glicada elevada, e que apresentam cicatrização deficiente.
- Contaminação e condições da parede abdominal: cuja presença de tecidos fibróticos, retrações cicatriciais e sua consequente má perfusão possam predispor à infecções e outras ocorrências do sítio cirúrgico.
- Cenário clínico: sendo tecnicamente mais exigentes os pacientes em situações de urgência, múltiplas recorrências, necessidade de abordagens viscerais concomitantes à cirurgia da parede abdominal, como por exemplo enterectomias ou fechamento de ostomias.
É possível saber qual paciente precisará de cirurgia com separação de componentes?
Recomenda-se planejar a cirurgia de reconstrução de parede abdominal com tomografia computadorizada, dentre suas utilidades, é possível predizer o porte da cirurgia. A equação de Carbonell é um cálculo que tem se demostrado eficiente em apontar os casos que necessitarão de um porte mais avançado de cirurgia com técnica de separação de componentes. Ele é realizado somando-se a largura dos dois músculos reto abdominais que devem apresentar uma proporção mínima de 2:1 em relação ao diâmetro transverso da hérnia. (Σ retos abdominais > 2x diâmetro da hernia = não precisar separar componentes).
Como mensurar uma perda de domicílio?
Existem cálculos específicos para aferir a volumetria da cavidade abdominal e que são extremamente uteis no planejamento cirúrgico do paciente com hérnia complexa. Para medir o volume de uma estrutura com formato elipsóide, tal qual o saco herniário ou a cavidade abdominal, é preciso aplicar uma fórmula matemática que é uma adaptação do volume da esfera. O volume de uma elipse pode ser obtido resolvendo a equação 4/3 x 3,14 x (diâmetro latero-lateral / 2 x diâmetro longitudinal /2 x altura /2) tudo isso elevado à terceira potência. É até interessante saber a origem desta equação, mas existem calculadoras on line que nos ajudam a simplificar as aferições no dia a dia.
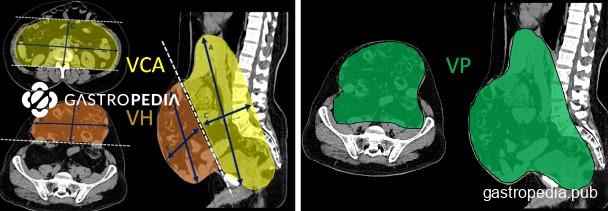
Assim, podemos obter tanto o volume da hérnia (VH) quanto o volume da cavidade abdominal (VCA). Se somarmos VH com VCA, teremos o volume peritoneal total que corresponde ao total de vísceras (VP=VH+VCA); se dividirmos VH por VCA, obteremos percentualmente o quanto o saco herniário representa em relação à cavidade abdominal e que usualmente denominamos como perda domicílio abdominal (PDA); se dividirmos o VH por VP, teremos a relação percentual do quanto o saco herniário representa no volume peritoneal total, que também é conhecido como índice peritoneal (IP)
Então, as medidas volumétricas são:
- VH=0,52 x a x b x c (cm3 ou mL)
- VCA=0,52 x A x B x C (cm3 ou mL)
E as relações volumétricas são:
- VP=VH+VCA (cm3 ou mL)
- PDA=VH/VCA (%)
- IP=VH/VP (%)
A seguir, vamos compreender como esses números podem nos auxiliar no planejamento peri-operatório, partindo-se algumas questões que são importantes para o cirurgião.
Será possível fechar a linha média?
Perdas de Domicílio Abdominal menores de 25%, remetem 92% de sucesso na síntese completa da linha média. Isso quer dizer que é improvável deixar tela em ponte entre os retos, que não é considerado um reparo fisiológico, ou ainda, que seja necessário usar telas revestidas, que são mais caras e normalmente precisam ser solicitadas com antecedência. Por outro lado, a medida do Índice Peritoneal menor 20% sugerem que não haverá tensão no fechamento da linha média. Clinicamente isso significa que estes casos apresentam menor risco de deiscência da aponeurose e menores chances de hipertensão intra abdominal no pós-operatório.
Haverá necessidade de terapia intensiva no pós-operatório?
Perdas de Domicílio Abdominal maiores que 30,6%, denotam necessidade de internação em terapia intensiva por falência respiratória em quase um terço dos pacientes, nas 48 horas subsequentes a cirurgia. Uma medida de Índice Peritoneal maior que 33% remetem à níveis elevados de pressão de platô endotraqueal no pós-operatório. Isso significa que podemos esperar por algum grau de hipertensão intra-abdominal, sendo a síndrome compartimental o evento mais extremo.
E se esses fatores de risco forem identificados no pré-operatório?
Considere utilizar métodos adjuvantes como a aplicação de toxina botulínica e pneumoperitônio progressivo, que ajudarão a alterar a dinâmica e o comportamento entre saco herniário e a cavidade abdominal, otimizando os resultados. A flacidez muscular obtida por ação da toxina botulínica produz alteração da complacência da cavidade abdominal e reduz a razão entre o VH/VCA de 30% para 23% e o Índice Peritoneal de 23% para 18%, que podem representar a diferença entre um pós operatório com necessidades intensivas e dificuldade no fechamento da linha média, para um pós-operatório menos turbulento.
O risco de tromboembolismo é igual nesta cirurgia?
A fisiopatologia dos eventos tromboembólicos na cirurgia de reconstrução de parede abdominal apresenta menor relação com hipomobilidade. O aumento da pressão intra-abdominal pode alterar o fluxo na cava e levar à eventos trombo-embólicos sem, no entanto, haver trombose venosa profunda de membros inferiores. Recomenda-se calcular este risco através dos critérios propostos por Caprini et al.
Conclusões:
As hérnias complexas acompanham pacientes complexos. Neste contexto, o cirurgião deve antecipar-se aos problemas e preparar adequadamente os seus pacientes: o planejamento cirúrgico é componente chave para obtenção de melhores resultados. Contextualize sua equipe multidisciplinar sobre os casos complexos e certifique-se de que o seu hospital tem condições ideais para cuidar de um pós-operatório com necessidades especiais.
Referências:
- Slater NJ, Montgomery A, Berrevoet F, Carbonell AM, Chang A, Franklin M, Kercher KW, Lammers BJ, Parra-Davilla E, Roll S, Towfigh S, van Geffen E, Conze J, van Goor H. Criteria for definition of a complex abdominal wall hernia. Hernia (2014)
- Amaral PHF, Macret JZ, Dias ERM, Roll S et al. Volumetry after botulinum toxin A: the impact on abdominal wall compliance and endotracheal pressure. Hernia (2024)
- Tanaka EY et al. A computerized tomography scan method for calculating the hernia sac and abdominal cavity volume in complex large incisional hernia with loss of domain. Hernia (2010)
- Dias ERM, Amaral PHF, Macret JZ, Roll S et al. Systematic review and meta-analysis of the pre-operative application of botulinum toxin for ventral hernia repair. Hernia (2023)
- Fafaj A, Tastaldi L, Krpata DM, Rosen MJ et al. Can Hernia Sac to Abdominal Cavity Volume Ratio Predict Fascial Closure Rate for Large Ventral Hernia? Reliability of the Tanaka Score. Hernia (2021)
- Said S, Krpata D, Rosen M et al. Tanaka score predicts surgical intensive care admission following abdominal wall reconstruction. Hernia (2022)
- Sabbagh C et al. Peritoneal volume is predictive of tension-free fascia closure of large incisional hernias with loss of domain: a prospective study. Hernia (2011)
- Kraft CT, Janis JE. Venous Thromboembolism after Abdominal Wall Reconstruction: A Prospective Analysis and Review of the Literature. Plast Reconstr Surg. (2019)
Como citar este artigo
Amaral P, Dias E, Macret J, Carvalho JP, Pivetta L, Roll S, Reconstrução de parede abdominal no paciente portador de hérnia ventral complexa: os impactos do planejamento cirúrgico Gastropedia 2024; vol 1. Disponível em: https://gastropedia.pub/pt/cirurgia/reconstrucao-de-parede-abdominal-no-paciente-portador-de-hernia-ventral-complexa-os-impactos-do-planejamento-cirurgico/