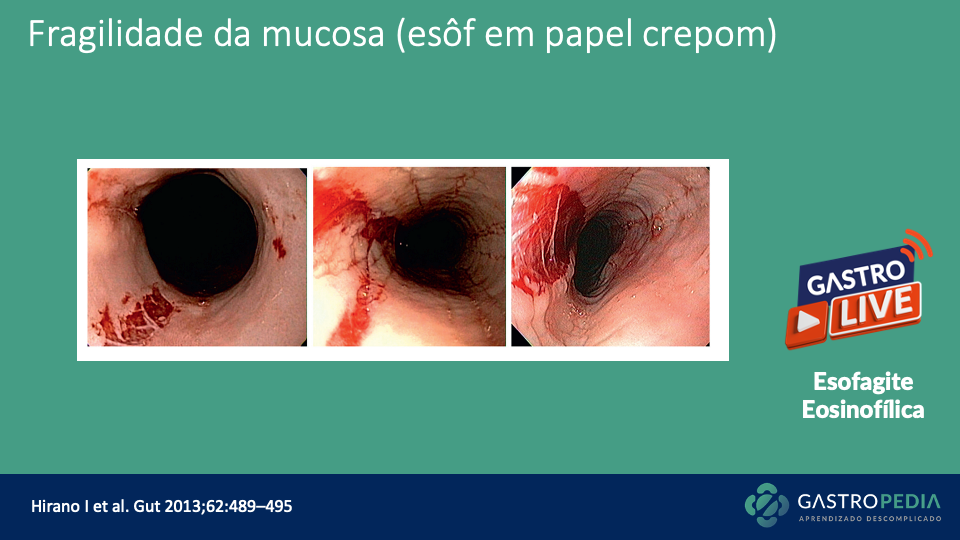
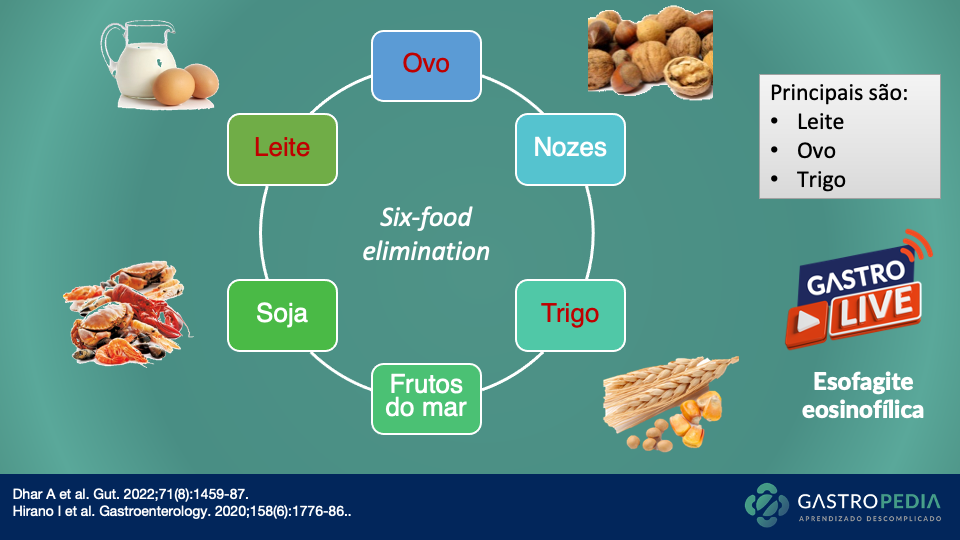
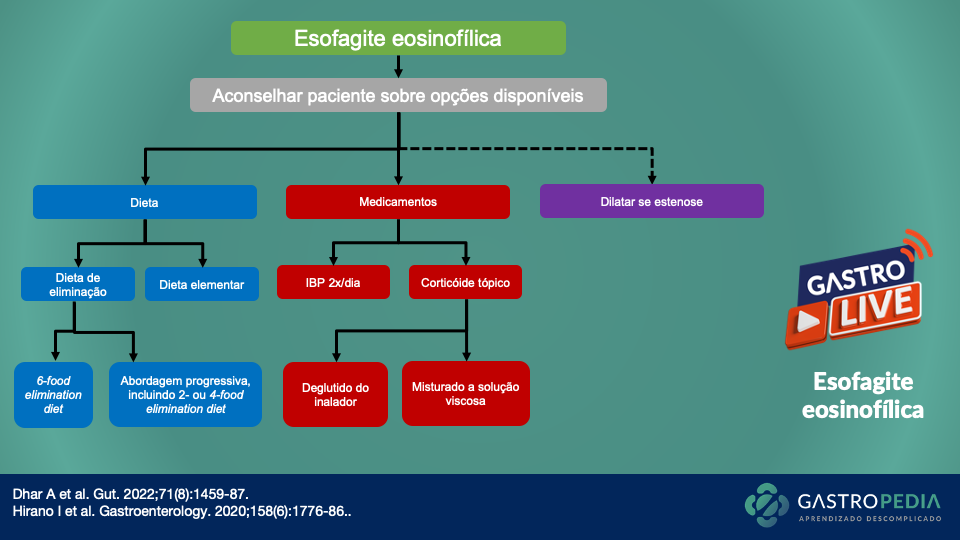
Gastroparesia: quando pensar, por que ocorre e como diagnosticar
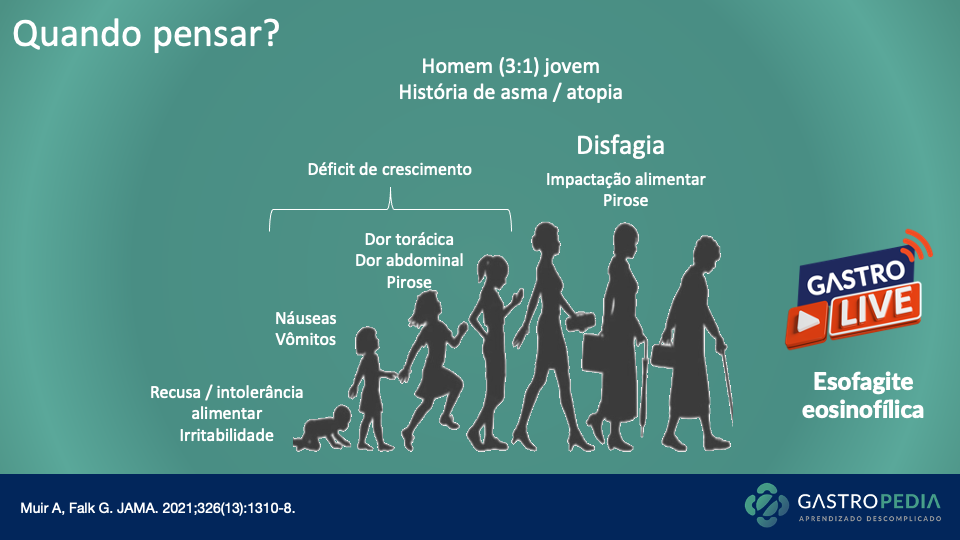
Quando pensar?
Gastroparesia significa literalmente “paralisia do estômago”. É um distúrbio caracterizado por contrações gástricas mais fracas e lentas do que o necessário para digerir a comida e passá-la para o intestino, fazendo com que a comida fique muito tempo no estômago.
Náuseas e vômitos são, sem dúvidas, os sintomas cardinais na gastroparesia. Contudo, outros sintomas dispépticos, tais como plenitude pós-prandial, saciedade precoce, dor epigástrica, inchaço (“bloating”) na parte superior do abdome e eructação estão frequentemente presentes. Esses sintomas, no entanto, podem se sobrepor amplamente com os de dispepsia funcional, tornando o diagnóstico mais desafiador.
- Nos Estados Unidos, com base em banco de dados de sinistros de seguro, a prevalência padronizada de gastroparesia foi de 267,7 por 100.000 adultos
- a prevalência de gastroparesia “definitiva” (indivíduos com sintomas persistentes por mais de 3 meses + cintilografia confirmatória) foi de 21,5 por 100.000 pessoas.
- A análise demonstrou uma prevalência duas vezes maior em mulheres e maior entre 58 a 64 anos. (Ye Y et al. 2022).
As etiologias mais frequentes de gastroparesia são diabetes mellitus (37.5%–57.4%), idiopática (11.3%–39.4%), medicamentos (11.8%–19.6%) e pós-cirúrgico (1.1%– 15.0%). Outras etiologias possíveis associadas são colagenoses, doenças neurológicas e hipotireoidismo.
Quando consideramos especificamente os diabéticos, a incidência cumulativa estimada em 10 anos é de 5,2% em diabetes mellitus tipo 1 e de 1,0% em tipo 2 (apesar da gastroparesia por DM2 ser muito mais prevalente, visto esse tipo de diabetes ser muito mais comum). Na Tabela 1, estão listadas as principais etiologias.
| Etiologia | Prevalência estimada |
| Diabetes mellitus | 37,5 – 57,4% |
| Idiopática (muitos desses pacientes provavelmente tiveram um insulto infeccioso ou inflamatório prévio) | 11,3 – 39,4% |
| Medicamentos (opioides, anticolinérgicos, agonistas dopaminérgicos, análogos de GLP-1, agonistas canabinoides, bloqueadores de canais de cálcio) | 11,8 – 19,6% |
| Pós-cirúrgico (vagotomia, fundoplicatura, bariátrica, gastrectomia parcial, colecistectomia, transplante cardíaco ou pulmonar, ablação por radiofrequência) | 1,1 – 15,0% |
| Doenças do tecido conjuntivo (esclerose sistêmica, lúpus) | 5,0% |
| Doenças neurológicas (Parkinson, Alzheimer, esclerose múltipla, distrofia muscular, paralisia cerebral) | |
| Doenças endocrinológicas (Hipotireoidismo descompensado, insuficiência adrenal, hipopituituarismo) | |
| Radiação | |
| Paraneoplásico | |
| Doença infiltrativa (linfoma, amiloidose) | |
| Doenças vasculares |
Portanto, a gastroparesia deve ser considerada em pacientes com sintomas crônicos de náusea, vômito, saciedade precoce e/ou dor abdominal, principalmente naqueles com diabetes, histórico de cirurgias abdominais ou torácicas, colagenoses, doenças neurológicas ou em uso de medicamentos de risco. Além disso, a gastroparesia pode estar presente em até 10% dos pacientes com doença do refluxo gastroesofágico (DRGE) refratária.
Outra dica importante é considerar este diagnóstico naqueles que, apesar de relatarem jejum adequado para o exame, apresentam endoscopia digestiva alta com grande quantidade de resíduos gástricos sem sinais de obstrução.
Por que ocorre?
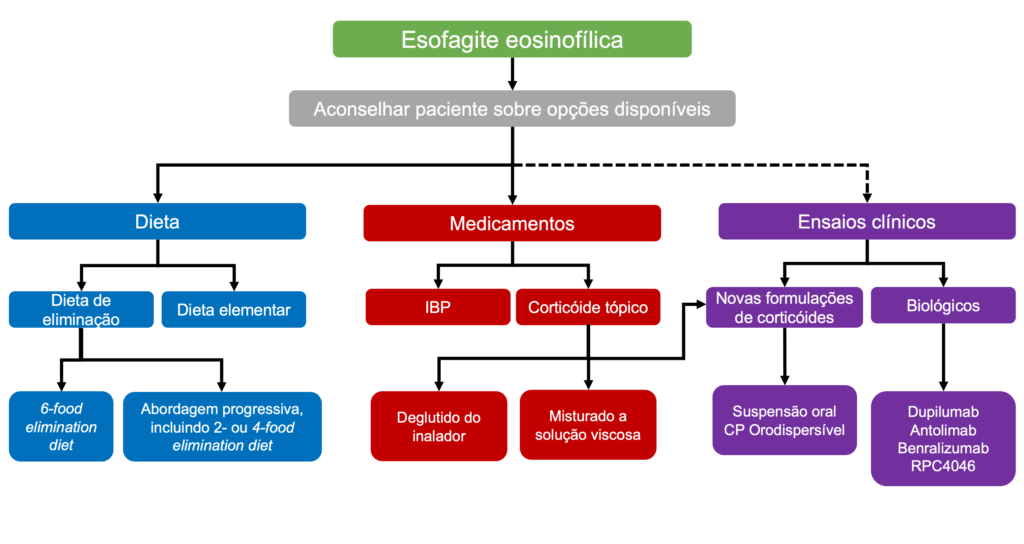
A gastroparesia decorre de qualquer alteração que induza disfunção neuromuscular do trato gastrointestinal, uma vez que o esvaziamento gástrico reflete a coordenação de diferentes regiões do estômago e duodeno, bem como a modulação extrínseca do sistema nervoso central. Isso inclui relaxamento fúndico para acomodação do alimento, contrações antrais, relaxamento pilórico e coordenação do antro, piloro e duodeno, conforme descrito na Figura 1. Além disso, há evidências de que tanto a hipersensibilidade visceral quanto a central são relevantes de um ponto de vista fisiopatológico para alguns pacientes com gastroparesia.
Muitos dos pacientes com gastroparesia idiopática provavelmente tiveram um insulto infeccioso ou inflamatório prévio. Essa hipótese é sustentada pela observação de que alguns pacientes relataram início súbito de sintomas após um pródromo viral, inclusive com relatos pós-COVID-19. A gastroparesia pós-viral geralmente melhora ao longo de um ano. No entanto, uma pequena proporção de pacientes com infecções por vírus como citomegalovírus, herpes vírus, norovírus, varicela zoster e Epstein-Barr pode estar associada a disautonomia aguda, que resulta em distúrbio generalizado da motilidade, levando a levando a sintomas persistentes.
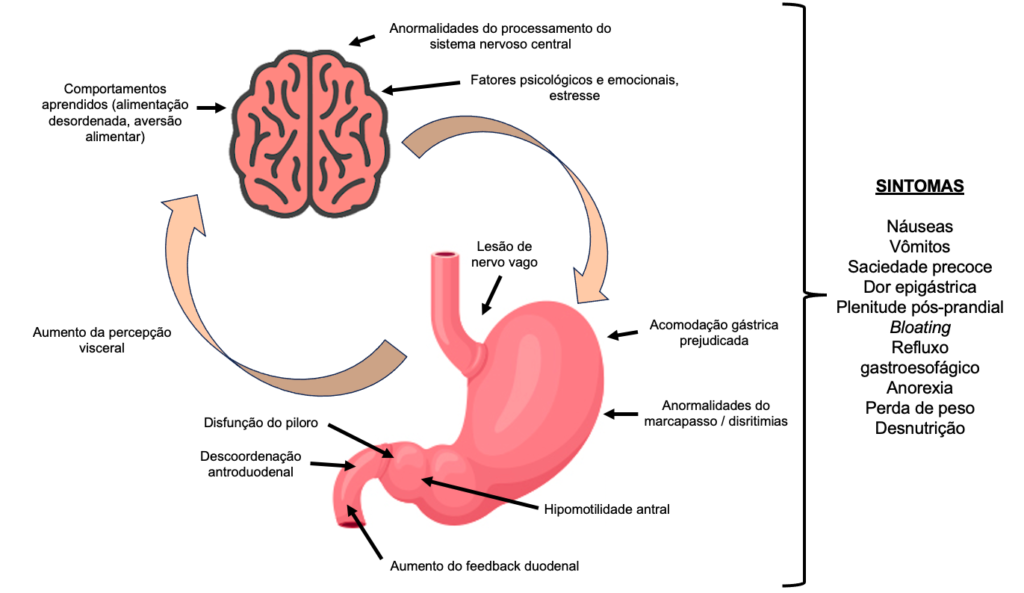
Fisiopatologia dos mecanismos envolvidos na geração dos sintomas de gastroparesia. Adaptado de Lacy BE et al, 2022 [2]
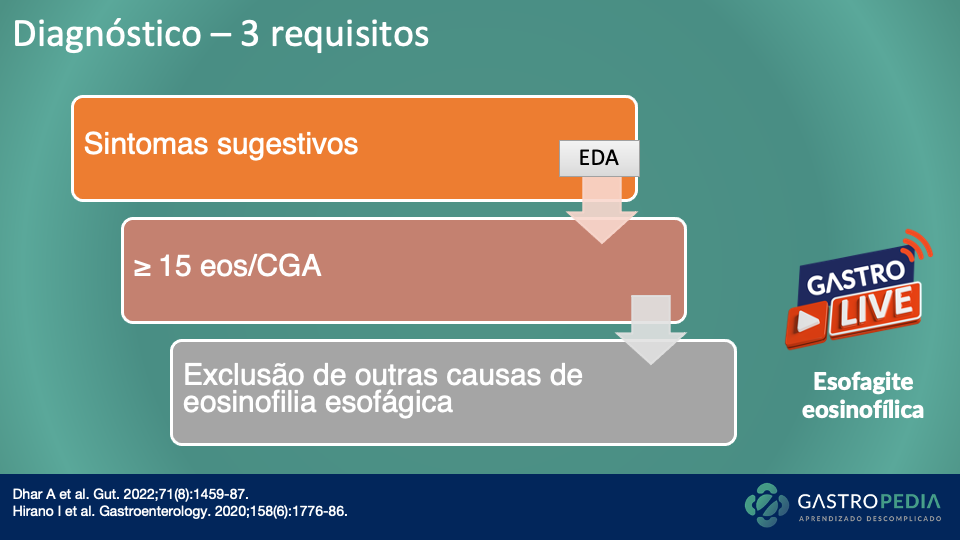
Como diagnosticar?
Uma anamnese detalhada, incluindo uma revisão de medicamentos e fatores de risco, é o ponto de partida para um adequado diagnóstico de gastroparesia. Posteriormente, o exame físico pode excluir uma causa orgânica (por exemplo, uma massa, evidência de obstrução intestinal parcial), identificar etiologias subjacentes (por exemplo, esclerodermia) e avaliar sinais de desnutrição. Exames laboratoriais básicos devem ser realizados (hemograma completo, perfil metabólico básico, TSH, hemoglobina glicada).
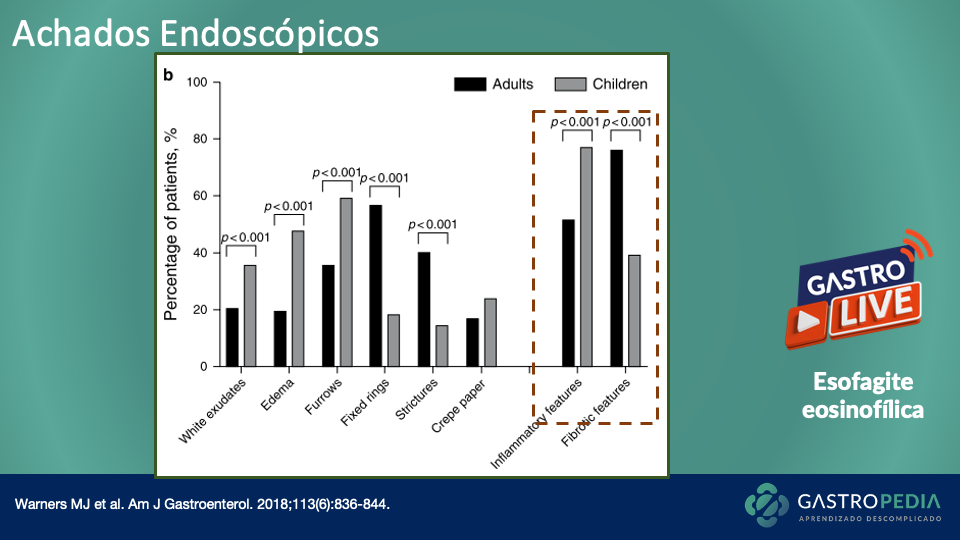
A endoscopia digestiva alta é obrigatória para descartar uma causa mecânica dos sintomas. Biópsias podem ser realizadas, caso necessário. Em caso de suspeita clínica, também podem ser necessários exames de imagem para excluir obstrução mecânica, como a tomografia computadorizada e a ressonância magnética de abdome (considerar realização de protocolos com enterografia).
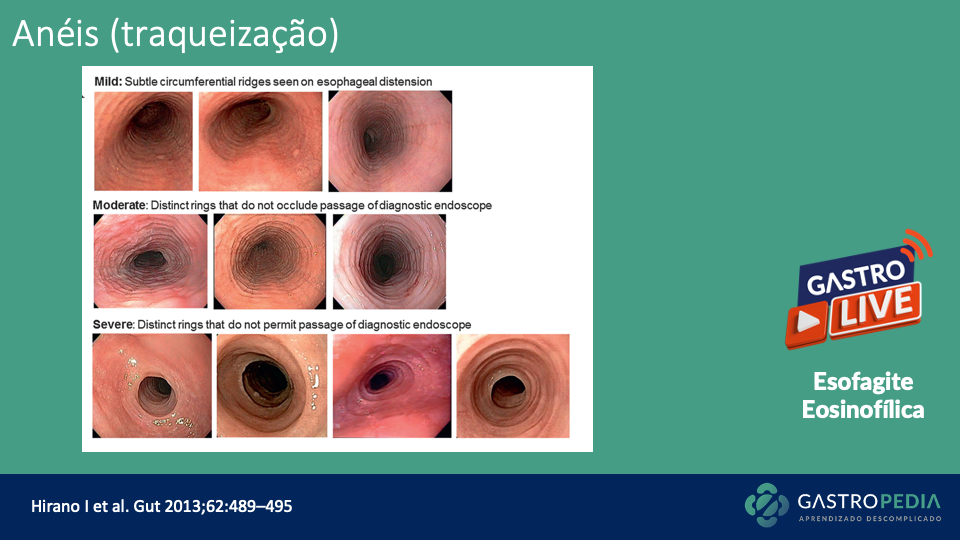
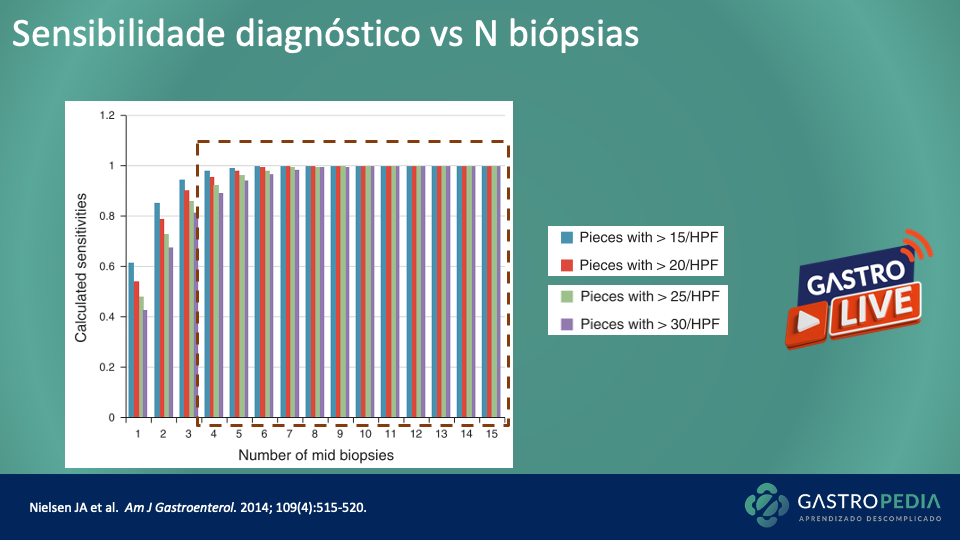
O exame padrão-ouro para o diagnóstico de gastroparesia é a cintilografia para determinação do tempo de esvaziamento gástrico (Figura 2), com uma refeição sólida radiomarcada. Trata-se do método mais custo-efetivo, simples e disponível para avaliar a motilidade gástrica.
Medicações que afetam a motilidade gástrica devem ser interrompidas pelo menos 48 horas antes do exame. Em pacientes diabéticos, a hiperglicemia deve ser tratada antes do exame – o teste deve ser realizado apenas com glicemia capilar inferior a 180 mg/dL.
Estabeleceu-se que os valores de referência compatíveis com retardo de esvaziamento gástrico são:
- Retenção gástrica > 60% em 2 horas;
- E/OU Retenção gástrica > 10% em 4 horas.
Apesar de classicamente não haver correlação entre intensidade de sintomas com as taxas de esvaziamento gástrico, a retenção gástrica em 4 horas pode ser classificada em:
- Leve: retenção de 10 a 15%;
- Moderada: retenção de 15 a 35%;
- Grave: retenção > 35%.
É essencial que a avaliação do esvaziamento seja continuada por 4 horas após a ingestão da refeição, pois essa medida tem uma sensibilidade maior quando comparada com a avaliação em 2 horas.
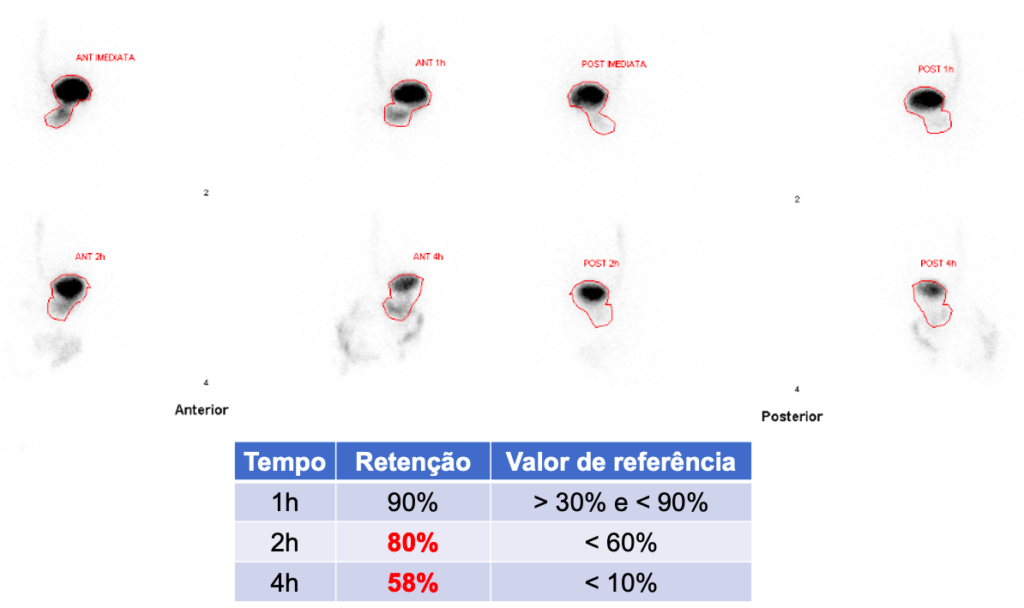
Cintilografia de esvaziamento gástrico mostrando retenção importante de radiofármaco 2 e 4 horas após a ingestão de 99mTc-enxofre coloidal misturado em alimento sólido (2 claras de ovos com sal + 2 fatias de pão, 30g de geleia e 120ml de água)
Outros métodos disponíveis para medir o esvaziamento gástrico são cápsulas de motilidade sem fio e testes respiratórios com isótopos estáveis (13C espirulina). No entanto, a reprodutibilidade é baixa a moderada e os testes são demorados e caros. Outra opção interessante para avaliar a motilidade gástrica é a eletrogastrografia, mas que também é um método pouco disponível.
Referências
- Ye Y, Yin Y, Huh SY, Almansa C, Bennett D, Camilleri M. Epidemiology, Etiology, and Treatment of Gastroparesis: Real-World Evidence From a Large US National Claims Database. Gastroenterology 2022;162:109-121.e5. doi:10.1053/j.gastro.2021.09.064.
- Lacy BE, Tack J, Gyawali CP. AGA Clinical Practice Update on Management of Medically Refractory Gastroparesis: Expert Review. Clin Gastroenterol Hepatol 2022;20:491–500. doi:10.1016/j.cgh.2021.10.038.
- Lacy BE, Cangemi DJ. Controversies in Gastroparesis: Discussing the Sticky Points. Am J Gastroenterol 2021;116:1572–6. doi:10.14309/ajg.0000000000001243.
- Sato H, Grover M. Gastroparesis and Functional Dyspepsia: Spectrum of Gastroduodenal Neuromuscular Disorders or Unique Entities? Gastro Hep Adv 2023;2:438–48. doi:10.1016/j.gastha.2022.10.005.
- Camilleri M, Kuo B, Nguyen L, Vaughn VM, Petrey J, Greer K, et al. ACG Clinical Guideline: Gastroparesis. Am J Gastroenterol 2022;117:1197–220. doi:10.14309/ajg.0000000000001874.
- Camilleri M, Chedid V, Ford AC, Haruma K, Horowitz M, Jones KL, et al. Gastroparesis. Nat Rev Dis Prim 2018;4. doi:10.1038/s41572-018-0038-z.
- Schol J, Wauters L, Dickman R, Drug V, Mulak A, Serra J, et al. United European Gastroenterology (UEG) and European Society for Neurogastroenterology and Motility (ESNM) consensus on gastroparesis. United Eur Gastroenterol J 2021;9:287–306. doi:10.1002/ueg2.12060.
- Cangemi DJ, Lacy BE. Gastroparesis : Myths , Misconceptions , and Management 2023:65–78.
Como citar este artigo
Lages RB. Gastroparesia: quando pensar, por que ocorre e como diagnosticar Gastropedia 2023, vol. 2. Disponível em:
gastropedia.pub/pt/sem-categoria/gastroparesia-quando-pensar-por-que-ocorre-e-como-diagnosticar/