Consenso do American College of Gastroenterology para tratamento de Helicobacter pylori: o que temos de novo?
1. Quando tratar?
– A grande questão é que não seria necessário testar H. pylori em todos. A determinação de quando testar e quando tratar deveria ser vista como uma decisão única e não como duas decisões separadas.
– Estaria indicado pesquisar o H. pylori em: queixas dispépticas, úlcera péptica, linfoma MALT, adultos que residem na mesma casa de indivíduos com H. pylori positivo por teste não sorológico (essa indicação não é clássica, mas foi adicionada neste consenso atual – “adult household members of individuals positive for H. pylori by nonserological testing“), uso prolongado de AINEs ou AAS profilático, anemia ferropriva inexplicada, púrpura trombocitopênica idiopática, gastrite atrófica, metaplasia ou displasia gástrica, adenoma ou adenocarcinoma gástricos, histórico de câncer gástrico em familiar de primeiro grau e em populações de alto risco para câncer gástrico.
– No entanto, sabemos que muitas vezes na prática diária os pacientes já nos procuram com exames com H. pylori positivo, mesmo que não encontremos uma clara indicação de pesquisa. Em concordância com o Maastricht VI (2022), o consenso americano sugere que, na ausência de contraindicações, o tratamento do H. pylori deve ser oferecido para todos os pacientes com infecção ativa.
2. Qual tratamento sugerido de primeira linha?
Pelo guideline americano, a primeira opção é terapia quádupla com bismuto:
BOTM – Subcitrato de Bismuto 120-300 mg ou subsalicilato 300 mg 6/6h + IBP em dose padrão 12/12h + Tetraciclina 500 mg 6/6h + Metronidazol 500 mg 8/8 ou 6/6h) preferencialmente por 14 dias (erradicação de 87% em 14 dias x 77% em 10 dias).
Além disso, NÃO se sugere a substituição de tetraciclina por doxicilina, pois pode reduzir erradicação (70% quando 14 dias com doxiciclina e 67% quando 10 dias com doxiciclina, diferente das taxas de até 87% com tetraciclina por 14 dias).
O uso desse esquema é limitado no Brasil devido à baixa disponibilidade de sais de bismuto. Há preocupação ainda quanto à aderência, pois o paciente precisa utilizar mais comprimidos, doses mais frequentes e costuma apresentar mais efeitos adversos (principalmente gastrointestinais, como náuseas e diarreia).
Apesar do guideline americano sugerir superioridade desta terapia em relação à tríplice com claritromicina devido ao aumento de resistência bacteriana (20 a 30% de resistência a claritromicina e até 40% de resistência a levofloxacino), devemos lembrar que no último consenso brasileiro (2018) tanto esta terapia quádrupla como a tríplice com claritromicina são colocadas como primeira linha. (leia mais aqui)
São sugeridas as seguintes opções como primeira linha:
- Terapia tríplice com rifabutina: Não disponível no Brasil. Há uma formulação própria nos Estados Unidos em que UMA cápsula contém Omeprazol 10 mg + Amoxicilina 250 mg + Rifabutina 12.5 mg. A posologia seria 4 cápsulas de 8/8h por 14 dias, isto é, dose equivalente de Omeprazol 40 mg + Amoxicilina 1 g + Rifabutina 50 mg 8/8h.
- Terapia dupla com vonoprazana (olhe nossa postagem sobre o tema: Terapia dupla com altas doses de amoxicilina): Vonoprazana 20 mg 12/12h + Amoxicilina 1 g 8/8h por 14 dias
- Terapia tríplice com vonoprazana: Vonoprazana 20 mg 12/12h + Amoxicilina 1 g 12/12h + Claritromicina 500mg 12/12h por 14 dias: O consenso recomenda CONTRA o uso de claritromicina, a não ser que seja possível realizar o teste de susceptibilidade. Contudo, sugere que, caso não tenha acesso ao teste de susceptibilidade para claritromicina, seja preferida a terapia tríplice com vonoprazana e não com IBP (e na nossa realidade infelizmente o teste de susceptibilidade não é um exame facilmente disponível). Evitar em pacientes que já utilizaram macrolídeo para tentar erradicar o H. pylori.
- Atentar que, segundo este consenso, a terapia tríplice com claritromicina não é recomendada como primeira linha, a não ser que seja possível realizar o teste de susceptilidade. Contudo, este ainda não é um exame disponível facilmente em nosso país e, diante da também baixa disponibilidade de terapia quádrupla com bismuto no Brasil, devemos considerar que a terapia tríplice ainda tem sim papel na nossa realidade.
Em caso de alergia a penicilina:
- Preferir o esquema quádruplo com bismuto
- Considerar consulta com alergista para dessensibilização, uma vez que < 1% da população apresenta alergia verdadeira à penicilina mediada por IgE tipo 1
- Atentar, porém, que muitas vezes nossos pacientes não terão acesso ao alergista para dessensibilização. Nessa caso, caso não seja possível a dessensibilização, sugerimos seguir o recomendado pelo consenso brasileiro (2018) – BOTM ou OCL, conforme você pode conferir em publicação prévia do nosso site (clique aqui).
3. Como realizar controle de cura após erradicação?
Nada mudou nesse tema. Todos os pacientes devem realizar controle de cura (respiratório, antígeno fecal ou método invasivo) pelo menos 4 semanas após término do tratamento.
4. Tratamento de segunda linha (após falha inicial)
- Se disponíveis, testes de suceptibilidade (culturas ou testes moleculares) são indicados tanto antes do primeiro tratamento como após falha terapêutica – contudo usualmente não há disponibilidade no Brasil.
- Se não tiver utilizado terapia quádrupla com bismuto, recomenda-se que ela seja utilizada.
- Se já utilizou terapia quádrupla com bismuto, recomenda-se terapia tríplice com rifabutina (não disponível no Brasil).
- Não repetir macrolídeo se já tiver utilizado.
- Terapia tríplice com levofloxacino é uma opção (IBP em dose padrão 12/12h + Levofloxacino 500 mg 1xd + Amoxicilina 1 g 12/12h por 14 dias), principalmente quando disponível teste de susceptibilidade para quinolona.
- Ainda não há evidência suficiente na América do Norte para recomendar a favor ou contra o uso de terapia dupla com altas doses de amoxicilina como esquema de resgate para pacientes falhados. Isso não significa que não pode ser um tratamento potencial em breve e que não possa ser considerado se as outras opções não estiverem disponíveis.
Na Tabela 1, há um resumo das recomendações. Devemos ficar atentos para adaptar estas recomendações para a nossa realidade local.
5. Uso de probióticos
Segundo este consenso do ACG, não há evidência suficiente que sugira que o uso de probióticos melhore a eficácia ou a tolerância da terapia de erradicação do H. pylori. Por outro lado, lembramos que no último consenso brasileiro (2018), sugeria-se que o uso de probióticos poderia melhorar a tolerância ao tratamento.
Por fim, um resumão deste consenso do ACG…
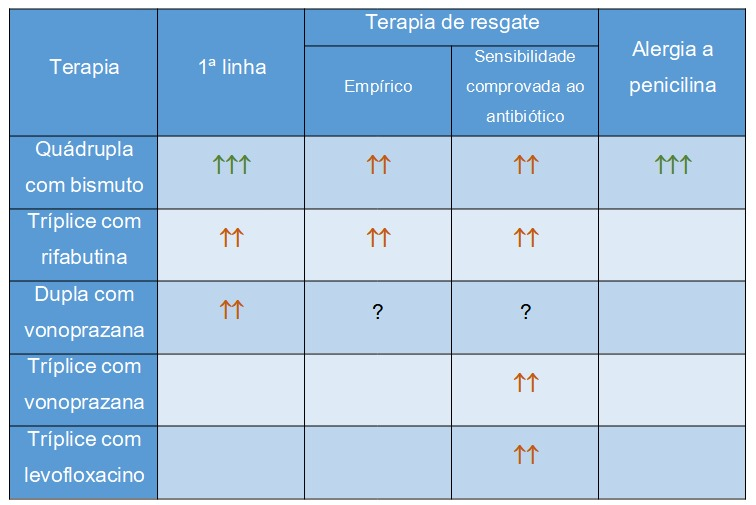
Legenda:
- ⬆⬆⬆= Recomendado
- ⬆⬆= Sugerido
- ? = Pode ser considerado se outros tratamentos não forem opção
- No caso de alergia a penicilina: Quando não for possível terapia quádrupla com bismuto, sugere-se avaliação do especialista para teste alérgico e/ou dessensibilização
- Obs: Vamos repetir para ficar bem claro. Segundo este consenso, a terapia tríplice com claritromicina não é recomendada como primeira linha, a não ser que seja possível realizar o teste de susceptilidade. Contudo, este ainda não é um exame disponível facilmente em nosso país e, diante da também baixa disponibilidade de terapia quádrupla com bismuto no Brasil, devemos considerar que a terapia tríplice ainda tem sim papel na nossa realidade. Segundo este consenso americano, caso não tenha acesso ao teste de susceptibilidade para claritromicina, seja preferida a terapia tríplice com vonoprazana e não com IBP.
Considerações finais
O novo consenso americano demonstra preocupação com o aumento da resistência bacteriana, principalmente à claritromicina, e por isso prioriza o uso de terapia quádrupla com bismuto. Há ainda destaque para uma nova opção, a terapia dupla com amoxicilina em altas doses + vonoprazana. Por fim, essa publicação novamente reafirma a importância do teste de susceptilidade, reforçando que devemos buscar meios para tornar este método mais disponível em nosso país.
Referências
- Malfertheiner P, Megraud F, Rokkas T, Gisbert JP, Liou JM, Schulz C, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut 2022;71:1724–62. doi:10.1136/gutjnl-2022-327745.
- Chey WD, Howden CW, Moss SF, Morgan DR, Greer KB, Grover S, et al. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol 2024;119:1730–53. doi:10.14309/ajg.0000000000002968.
Como citar este artigo
Lages RB. Consenso do American College of Gastroenterology para tratamento de Helicobacter pylori: o que temos de novo? Gastropedia 2025, Vol. 1. Disponível em: https://gastropedia.pub/pt/gastroenterologia/consenso-do-american-college-of-gastroenterology-para-tratamento-de-helicobacter-pylori-o-que-temos-de-novo/