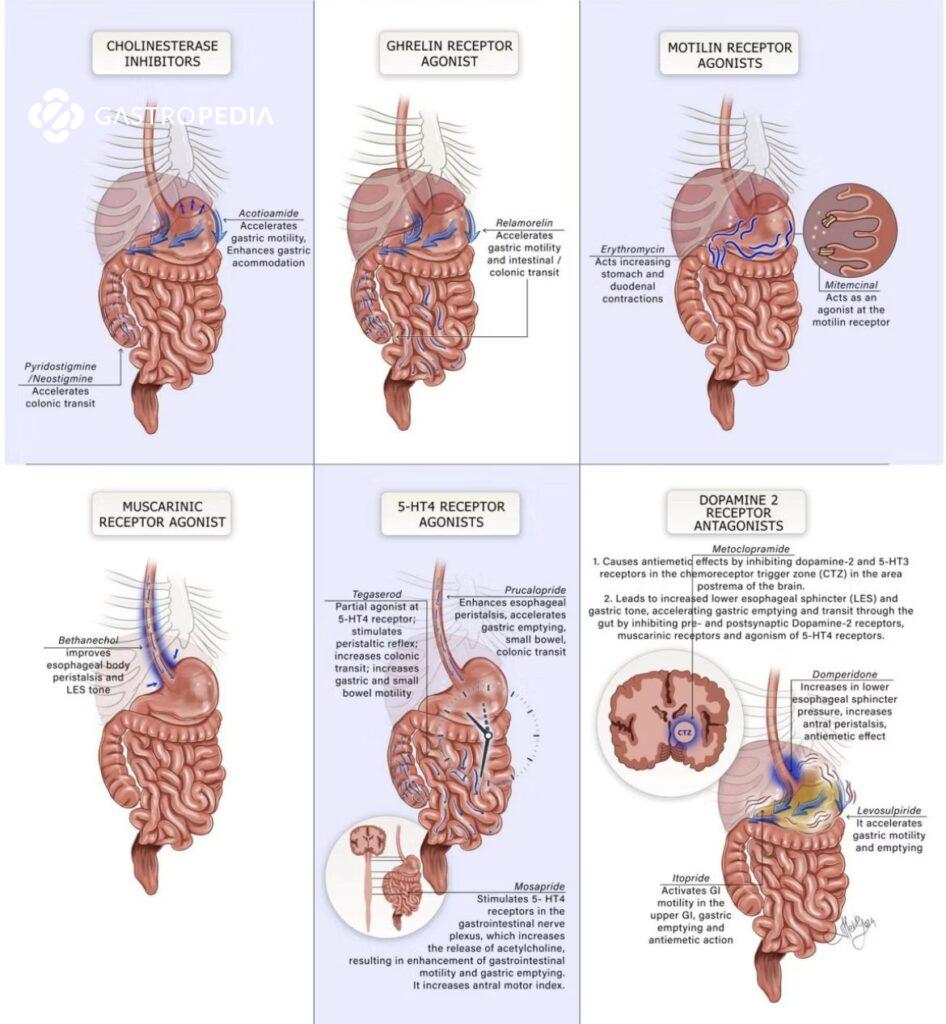
Disfunção do Esfíncter de Oddi
A disfunção do esfíncter de Oddi (DEO) é uma condição funcional ou estrutural rara que compromete o fluxo de bile e suco pancreático para o duodeno. É frequentemente subdiagnosticada, mas sua identificação e manejo adequados podem proporcionar melhora significativa na qualidade de vida dos pacientes.
Anatomia e Fisiologia do Esfíncter de Oddi
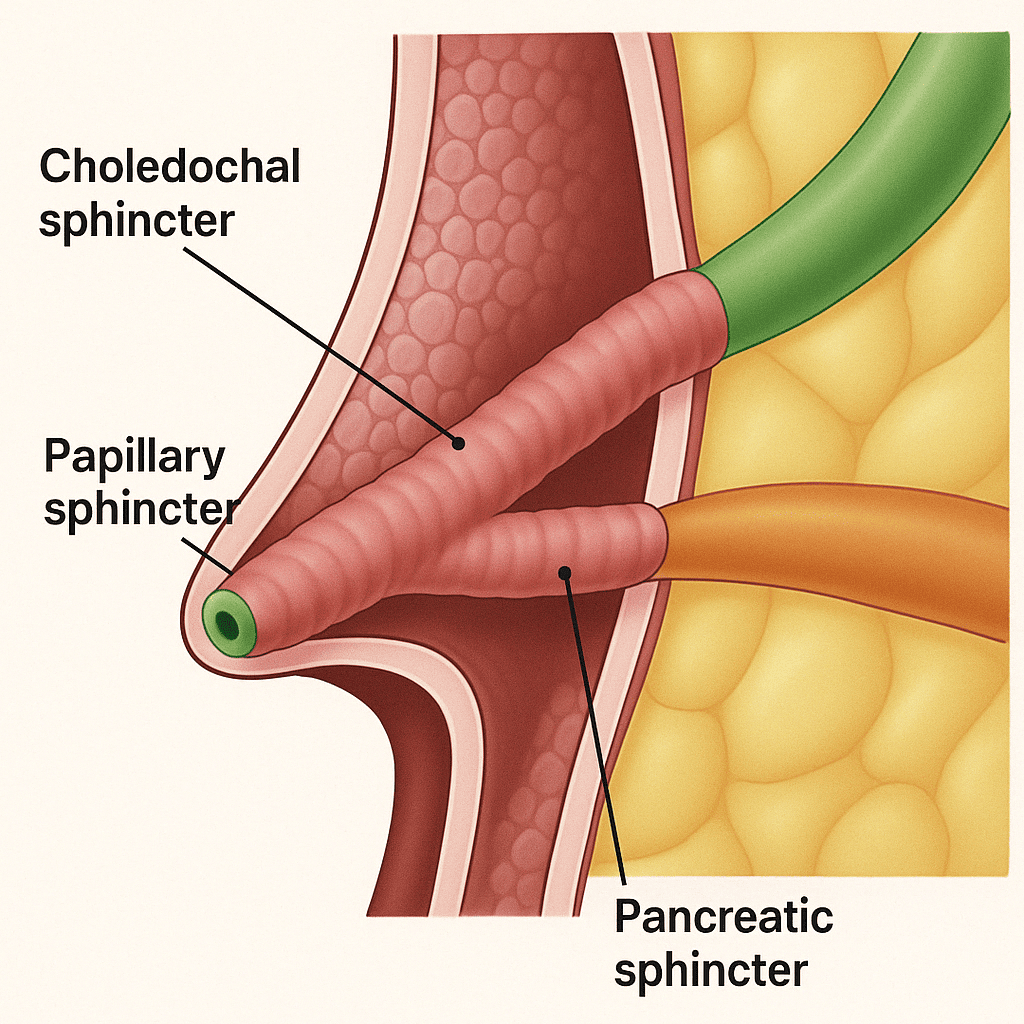
O esfíncter de Oddi (EO) é um complexo muscular que envolve a porção terminal do ducto colédoco e ducto pancreático, regulando a liberação de bile e enzimas pancreáticas para o duodeno. Suas funções principais incluem:
- controle do fluxo biliar e pancreático,
- prevenção de refluxo para ducto pancreático e biliar
- promoção do enchimento da vesícula biliar durante o período entre as refeições
O funcionamento do EO é modulado por estímulos hormonais (como a colecistocinina – CCK) e neurais (via nervo vago).
- A pressão basal normal do EO é de 10 mmHg, com aumentos de tônus intermitentes de 50 a 140 mmHg, ocorrendo de 2 a 6 vezes por minuto.
- A colecistocinina (CCK), liberada em resposta a uma refeição, promove a contração da vesícula biliar e o relaxamento do esfíncter, facilitando a digestão.
- Outras substâncias, como motilina, somatostatina e óxido nítrico, também influenciam sua motilidade.
- A inervação parassimpática (vagal) é principalmente excitatória para o EO.
Etiologia e Fatores de Risco
A DEO pode ser causada por estenose (causa mecânica) ou discinesia (motilidade alterada). Entre os fatores de risco mais reconhecidos estão: colecistectomia prévia, uso de opioides, alcoolismo, hipotireoidismo, síndrome do intestino irritável e antecedentes de pancreatite.
A retirada da vesícula biliar parece predispor à DEO ao eliminar o “reservatório” que modera aumentos de pressão no sistema biliar, o que pode levar a hipertonia do EO. Além disso, opioides como morfina e codeína podem induzir espasmos no esfíncter, exacerbando os sintomas.
Classificação Clínica
Os critérios diagnósticos específicos para DEO incluem:
- Dor abdominal do tipo biliar (vide “Diagnóstico” abaixo)
- Elevação de transaminases (>2x o limite superior da normalidade),
- Dilatação do ducto biliar comum (>10 mm na US ou >12 mm na CPRE)
Obs: antigamente utilizava-se também o critério de esvaziamento tardio (>45 min) do contraste na CPRE, mas hoje possuímos exames não invasivos para corroborar esse achado.
Com base na presença desses critérios, a DEO é dividida em tipos, conforme a classificação de Milwaukee.
| • Tipo I: dor biliar associada a dois dos critérios acima. • Tipo II: dor biliar + um dos critérios acima. • Tipo III: apenas dor biliar, sem achados laboratoriais ou de imagem. |
Essa classificação é fundamental para guiar a conduta diagnóstica e terapêutica.
(Nota: Existe também uma classificação de Milwaukee para DEO pancreática, com critérios semelhantes baseados em dor pancreática, enzimas pancreáticas elevadas, dilatação do ducto pancreático e drenagem retardada do contraste na CPRE.)
Diagnóstico
O diagnóstico é desafiador e frequentemente de exclusão.
A dor abdominal relacionada à disfunção do esfíncter de Oddi (DEO) é geralmente intermitente, localizada no hipocôndrio direito e pode ser acompanhada de náuseas e vômitos. Pode se manifestar como dor súbita e intensa com irradiação para região dorsal ou ombro e pode durar de 30 minutos a várias horas. A dor na DOE nem sempre está relacionada às refeições e tende a ocorrer de forma episódica.
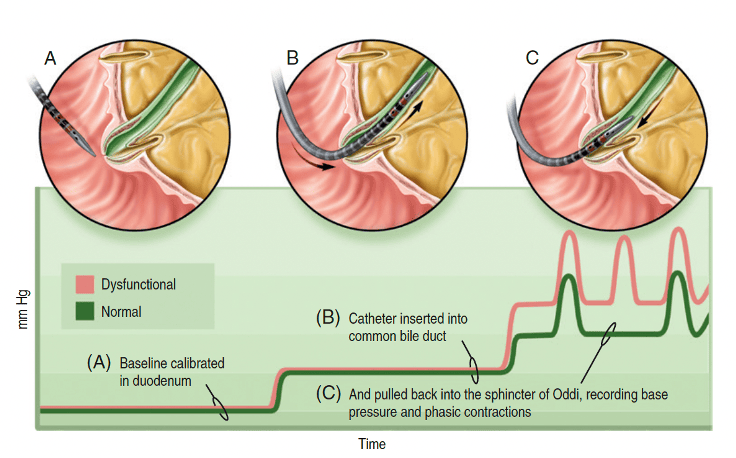
Exames laboratoriais (aminotransferases, bilirrubinas, amilase e lipase) e de imagem (ultrassonografia, tomografia, CPRM) ajudam a excluir outras causas. A manometria endoscópica do EO, realizada durante a colangiopancreatografia retrógrada endoscópica (CPRE), é o padrão-ouro, com valores pressóricos >40 mmHg indicando disfunção. No entanto, esse exame é invasivo, tecnicamente exigente e tem risco elevado de pancreatite.
Outros testes, como cintilografia hepatobiliar e CPRM com secretina, podem ser úteis, especialmente quando se deseja evitar métodos invasivos. A cintilografia hepatobiliar quantitativa avalia a drenagem biliar e pode detectar retardo no esvaziamento, útil principalmente em pacientes com dor pós-colecistectomia. Já a CPRM com secretina permite visualizar ductos biliares e pancreáticos com maior sensibilidade e avaliar a resposta à estimulação, sendo alternativa nos casos de disfunção pancreática.
O teste de Nardi, que associa morfina e neostigmina para provocar sintomas, também pode auxiliar, embora seja pouco utilizado na prática.
Tratamento
O tratamento depende do tipo de DEO:
- Tipo I: tratamento invasivo é geralmente indicado, com bons resultados após esfincterotomia endoscópica. O alívio da dor ocorre em aproximadamente 90% dos casos com DEO biliar tipo I.
- Tipo II: a esfincterotomia pode ser considerada, especialmente se a manometria estiver alterada. Aproximadamente 70% dos pacientes com DEO tipo II apresentam melhora significativa da dor após o procedimento.
- Tipo III: estudos como o EPISOD trial mostraram que pacientes com DEO tipo III não se beneficiam da esfincterotomia, sendo preferível o tratamento clínico.
A terapêutica medicamentosa inclui bloqueadores dos canais de cálcio (como nifedipina), antidepressivos tricíclicos, nitratos e somatostatina, com eficácia variável. Toxina botulínica e stents temporários têm sido usados como testes terapêuticos antes da decisão por intervenção definitiva.
Estudo EPISOD
O estudo multicêntrico EPISOD randomizou 214 pacientes com dor pós-colecistectomia e DEO tipo III para esfincterotomia ou procedimento placebo. Surpreendentemente, a taxa de sucesso foi maior no grupo placebo (37%) do que no grupo tratado (23%), sem associação entre a manometria e o desfecho clínico. O estudo concluiu que a esfincterotomia não deve ser indicada para pacientes com DEO tipo III.
Considerações Finais
A disfunção do esfíncter de Oddi é uma entidade complexa e heterogênea. Seu reconhecimento exige exclusão cuidadosa de outras causas e, quando confirmada, o tratamento deve ser personalizado conforme o tipo clínico. O manejo inadequado pode expor pacientes a procedimentos de alto risco, sem benefícios comprovados. A DEO tipo III, em especial, deve ser tratada de forma conservadora, evitando intervenções invasivas desnecessárias.
Referências
- Crittenden JP, Dattilo JB. Sphincter of Oddi Dysfunction. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 [cited 2025 May 7]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK557871/
- Afghani E, Lo SK, Covington PS, Pandol SJ. Sphincter of Oddi dysfunction. Front Nutr. 2017;4:1. doi:10.3389/fnut.2017.00001
- Cotton PB, Durkalski V, Romagnuolo J, Pauls Q, Payne KM, Mauldin P, et al. Effect of endoscopic sphincterotomy for suspected sphincter of Oddi dysfunction. JAMA. 2014;311(20):2101–9.
Como citar este artigo
Martins BC. Disfunção do Esfíncter de Oddi Gastropedia 2025; Vol 1. Disponível em: https://gastropedia.pub/pt/gastroenterologia/disfuncao-do-esfincter-de-oddi/