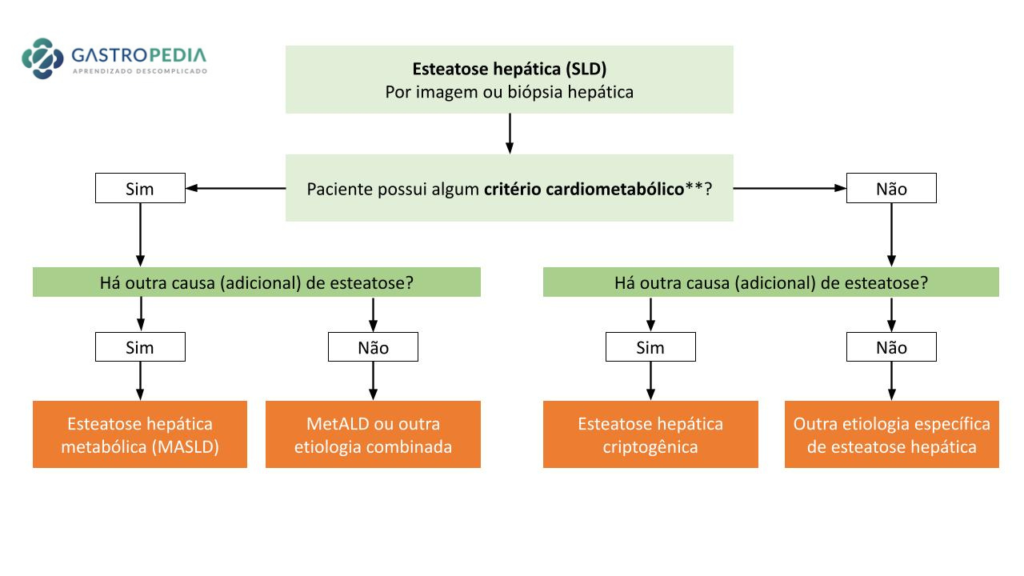
Quando suspeitar de Hepatite autoimune?
A Hepatite autoimune é uma doença de etiologia desconhecida, descrita por Jon Waldenstrom em 1950, em que ocorre destruição progressiva do parênquima hepático e que pode acarretar cirrose com elevada morbimortalidade na ausência de tratamento. A Hepatite autoimune acomete principalmente mulheres jovens, mas pode ser diagnosticada em ambos os sexos, em qualquer faixa etária (1,2). A doença caracteriza-se por hipergamaglobulinemia, reatividade de autoanticorpos circulantes, hepatite de interface ao exame histológico, suscetibilidade genética relacionada a antígenos leucocitários humanos (HLA) específicos e, ainda, pela resposta favorável ao uso de corticoide e imunossupressores (3,4).
O mecanismo patogênico da Hepatite autoimune é multifatorial, com participação de agentes desencadeantes (infecções, drogas, toxinas), predisposição genética e menor tolerância à ativação imunológica e expansão celular efetora (linfócitos T citotóxicos CD4/CD8) (5).
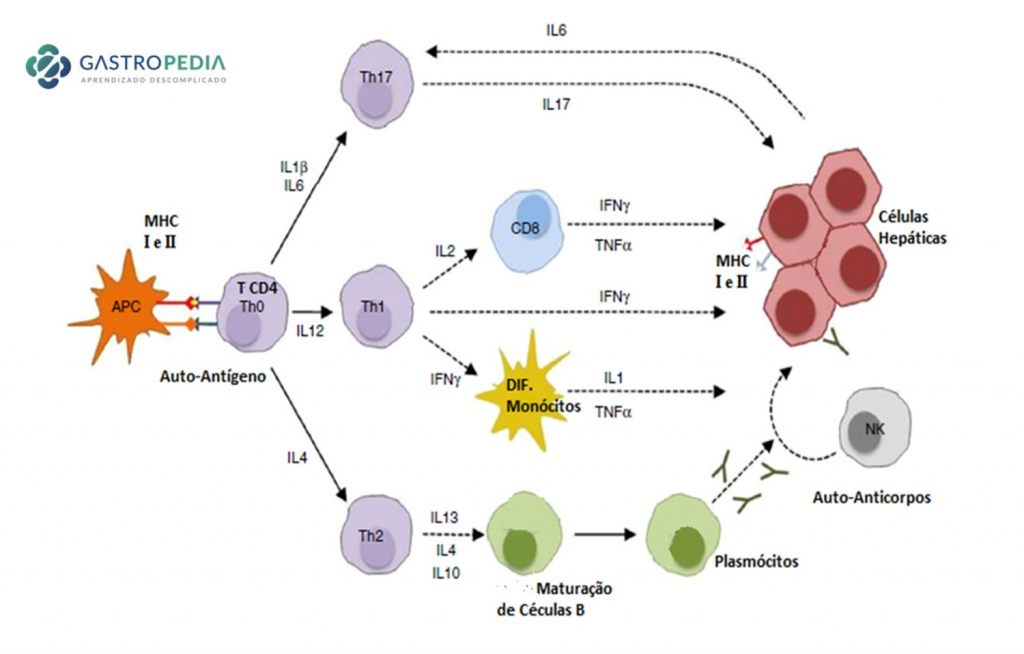
Figura 1 –Mecanismo de lesão hepática na hepatite autoimune
Fonte:
Falcão, Lydia Teófilo de Moraes. Estudo randomizado de cloroquina versus azatioprina, em associação com prednisona, no tratamento da hepatite autoimune [tese]. São Paulo, Faculdade de Medicina; 2018
A lesão hepática inicia-se com apresentação de autoantígenos pelas células apresentadoras de antígenos (APCs), com estímulo à diferenciação de células T CD4. As Interleucinas IL-6 e IL-1β estimulam a diferenciação na resposta Th17, com secreção de citocinas pró-inflamatórias IL-17 e de IL-6, a qual estimula ainda mais a diferenciação na resposta Th17. A exposição à IL-12 estimula a diferenciação na resposta Th1, com secreção de Interferon-γ e indução de diferenciação de monócitos. A exposição à IL-4 estimula a diferenciação na resposta Th2, que cursa com secreção de IL-13, IL-4 e IL-10, estimulando a maturação de células B em plasmócitos e consequente produção de autoanticorpos.
Quando suspeitar de Hepatite Autoimune?
A hepatite autoimune muitas vezes é subdiagnosticada. Para que haja suspeição, precisamos compreender as formas de apresentação da doença (6-7).
- Assintomática: 15-20% dos casos, apenas com elevação de enzimas hepáticas. Ou seja, mesmo na ausência de sintomas, na presença de elevação de enzimas hepáticas, especialmente aminotransferases, deve haver suspeita de HAI e serem solicitados exames para investigação etiológica. (confira mais sobre elevação de enzimas hepáticas neste post)
- Hepatite aguda: ocorre em 30% dos casos, sendo caracterizada por sintomas inespecíficos como astenia, anorexia, artralgia, dor abdominal, prurido, icterícia, colúria e acolia fecal. Menos frequentemente, a HAI é diagnosticada no contexto de insuficiência hepática aguda, com surgimento de encefalopatia, ascite, hemorragia digestiva, com indicação de transplante hepático em pacientes previamente assintomáticos.
- Insidiosa: caracteriza-se por fadiga progressiva, icterícia flutuante, anorexia, amenorreia e perda ponderal. Os sintomas inespecíficos retardam o diagnóstico e a doença evolui para a forma crônica.
- Crônica: caracterizada pelo surgimento de alterações clínico-laboratoriais e histológicas características de hepatopatia avançada, com presença ou não de hipertensão portal.
Dados de uma coorte do Hospital das Clínicas da Universidade de São Paulo (HC-FMUSP), composta por 268 portadores de HAI, evidenciou hepatite aguda como forma de apresentação mais prevalente (56%), hepatopatia crônica avançada em 25% e diagnóstico na forma assintomática em 10% dos casos (8). Há, ainda, formas atípicas de apresentação, com acometimento de ductos biliares e ausência de reatividade de autoanticorpos circulantes.
Diagnóstico da Hepatite Autoimune
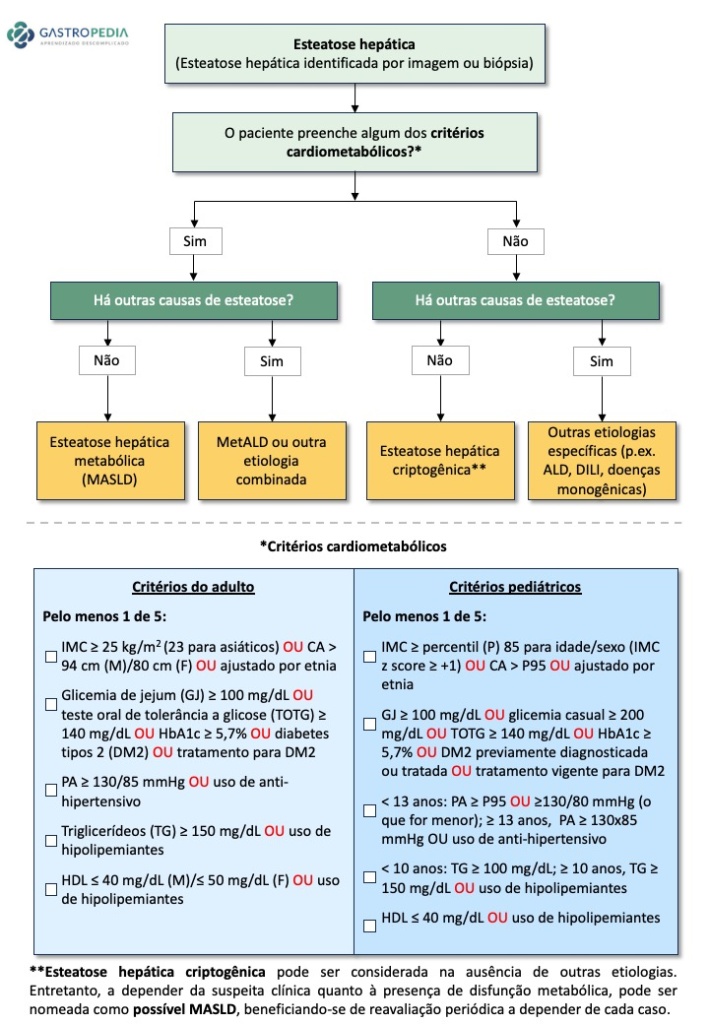
Os critérios para diagnóstico e resposta ao tratamento da hepatite autoimune foram definidos em 1993 e revisados em 1999 pelo Grupo Internacional de Hepatite Autoimune (Figura 2). Apesar dos critérios requererem a exclusão de outras etiologias de hepatopatias crônicas com aspectos clínico-laboratoriais semelhantes, muitas características da HAI podem estar presentes em outras doenças hepáticas, como a colangite biliar primária, colangite esclerosante primária, hepatopatia induzida por drogas, hepatites virais e esteato-hepatite alcoólica ou associada ao metabolismo, tornando muitas vezes o diagnóstico desafiador (9).
| Parâmetros | Pontuação |
|---|---|
| Sexo Feminino | +2 |
| FA/AST ou ALT (X acima do VN) | |
| < 1,5 | +2 |
| 1,5-3,0 | 0 |
| >3,0 | -2 |
| Gamaglobulina/IgG (número de vezes acima do VN) | |
| >2,0x | +3 |
| 1,5-2,0x | +2 |
| 1,0-1,5x | +1 |
| <1,0x | 0 |
| Autoanticorpos (FAN/AML/LKM1) | |
| >1:80 | +3 |
| 1:80 | +2 |
| 1:40 | +1 |
| < 1:40 | 0 |
| Outros marcadores (Anti-SLA/LP, anti-actina, anti-LC1, p-ANCA) | +2 |
| Antimitocôdria+ | -4 |
| Marcadores virais Anti-VHA IgM, AgHBs, anti-HBc IgM + |
-3 |
| Anti-VHC+ e RNA do VHC + | -3 |
| Anti-VHA IgM, AgHBs, anti-HBc IgM ou anti-VHC negativos | +3 |
| Uso recente de drogas hepatotóxicas positiva/negativa | -4/+1 |
| Consumo alcoólico | |
| < 25g/dia | +2 |
| >60g/dia | -2 |
| Outra doença autoimune no paciente ou em familiar de primeiro grau | +2 |
| Histologia: | |
| Hepatite de Interface | +3 |
| Rosetas | +1 |
| Plasmócitos | +1 |
| Nenhuma das alterações acima | -5 |
| Alterações biliares (de CBP e CEP) | -3 |
| Alteração sugestiva de outra etiologia | -3 |
| HLA DR3 ou DR4 DR7 ou DR13 (varaições regionais) |
+1 |
| Resposta Terapêutica | |
| Completa | +2 |
| Recidiva durante ou após suspensão do tratamento após resposta completa Inicial | +3 |
Critérios Diagnósticos Modificados da HAI pelo Grupo Internacional de Hepatite autoimune. Adaptado
(10). Interpretação: Antes do tratamento: > 15: diagnóstico definitivo,≤ 15 –
10: provável, Após tratamento: > 17: diagnóstico definitivo,≤ 17 -12: provável
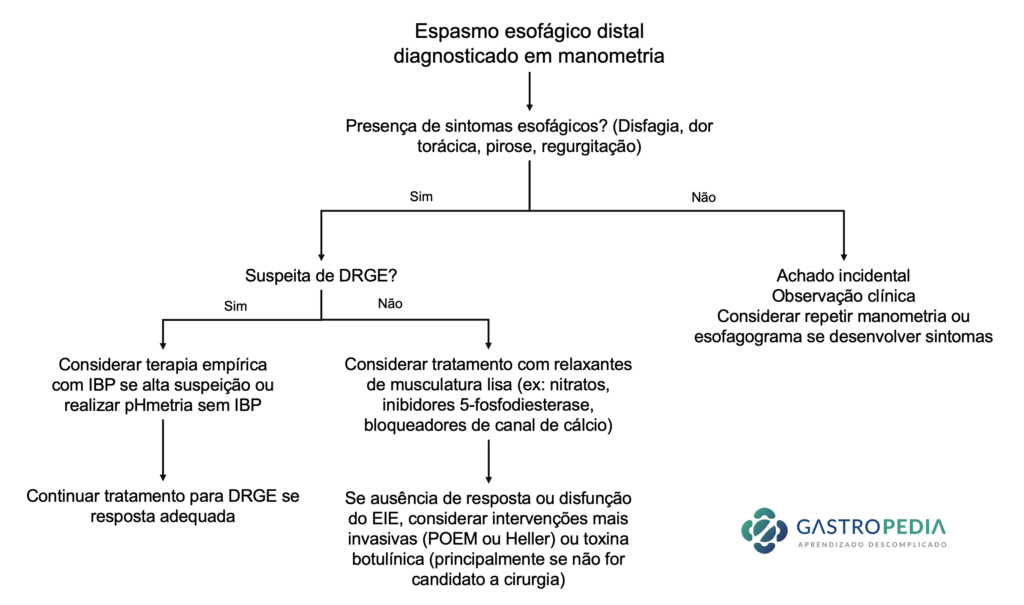
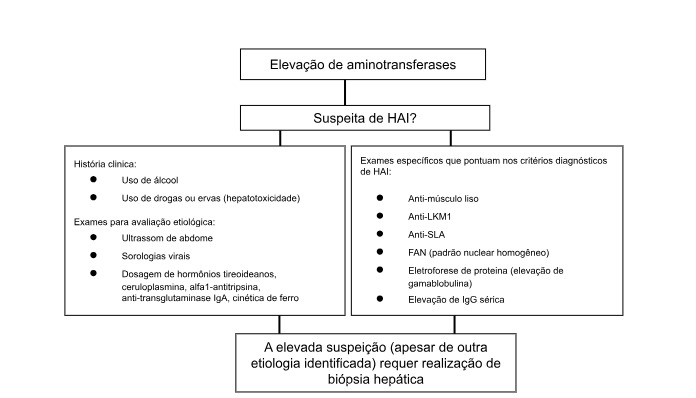
A suspeição da hepatite autoimune deve ocorrer em todas as formas de apresentação da doença, desde quadros assintomáticos, com elevação de aminotransferases em exames de rotina (Figura 3), até as formas sintomáticas, com presença ou não de hepatopatia crônica avançada. A importância da suspeição e do diagnóstico precoce deve-se ao fato de que o tratamento clínico pode induzir remissão clínico-laboratorial da doença, prevenir fibrogênese hepática e a evolução para hepatopatia crônica avançada.
Leia também: Pancreatite Autoimune
Referências
- Manns MP, Czaja AJ, Gorham JD, Krawitt EL, Mieli-Vergani G, Vergani D, et al. Diagnosis and management of autoimmune hepatitis. Hepatology. 2010;51(6):2193-213.
- Czaja AJ. Diagnosis and Management of Autoimmune Hepatitis: Current Status and Future Directions. Gut Liver. 2016;10(2):177-203.
- Lohse AW, Mieli-Vergani G. Autoimmune hepatitis. J Hepatol. European Association for the Study of the Liver. 2011;55(1):171-82.
- Zachou K, Muratori P, Koukoulis GK, Granito A, Gatselis N, Fabbri A, et al. Review article: autoimmune hepatitis — current management and challenges. Aliment Pharmacol Ther. 2013;38(8):887-913.
- Liberal R, Mieli-Vergani G. VD. Autoimmune hepatitis: From mechanisms to therapy. Rev Clin Esp. 2016;216(7):372-83.
- Manns MP, Vogel A. Autoimmune hepatitis, from mechanisms to therapy. Hepatology. SEGO; 2006;43(2 SUPPL. 1).
- Bittencourt PL, Cançado ELR, Couto CA, Levy C, Porta G, Silva AEB, et al. Brazilian society of hepatology recommendations for the diagnosis and management of autoimmune diseases of the liver. Arq Gastroenterol. 2015;52:15-46.
- Terrabuio DBR. 20 anos de hepatite auto-imune no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo [Dissertação]. USP; 2006.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Autoimmune Hepatitis. J Hepatol. 2015;63:971-1004.
- Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cançado EL, et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol 1999;31(5): 929-38.
Como citar este artigo
Falcão LTM. “Quando suspeitar de Hepatite autoimune?” Gastropedia 2023, vol. 2. Disponível em: https://gastropedia.com.br/gastroenterologia/figado/quando-suspeitar-de-hepatite-autoimune/