“Doctor, ¿qué es esa metaplasia que apareció en mi endoscopia? ¡Leí en Google que se convierte en cáncer de estómago! ¿Qué hago ahora?” – esta es una preocupación que probablemente ya has escuchado en el consultorio médico. Pero entonces, ¿sabes qué responder y qué hacer?
¿Qué es?
La inflamación crónica en el estómago genera un proceso regenerativo que puede estimular la transformación de la mucosa gástrica en células más parecidas a las que revisten los intestinos, lo que llamamos metaplasia intestinal (MI).
La prevalencia de MI es variable según la población estudiada (se relaciona, por ejemplo, con la prevalencia de H. pylori), siendo estimada en un 4,8% en los Estados Unidos, pero en hasta un 25% en algunas poblaciones asiáticas. Además, estudios demuestran una mayor prevalencia en grupos de edad más avanzados. No hay síntomas específicos asociados con la metaplasia en sí.
Pero si esa transformación que lleva a la MI es consecuencia de una inflamación gástrica, ¿cuáles serían los factores que pueden predisponer o acelerar esa evolución?
- Helicobacter pylori: Sin dudas, es el principal factor de riesgo para lesiones pre-cancerosas gástricas. El H. pylori aumenta la posibilidad de cáncer gástrico en 2 a 3 veces.
- Gastritis autoinmune: Aumento del riesgo de tumores neuroendocrinos gástricos tipo I y de adenocarcinoma.
- Tabaquismo
- Reflujo biliar
- Dieta: vegetales y frutas son generalmente factores protectores, mientras que dietas ricas en sal, procesados, ahumados y alimentos ricos en nitrosaminas aumentan el riesgo.
¿Cómo identificar?
En la endoscopia con luz blanca, la metaplasia intestinal se presenta superficialmente elevada o con áreas planas blanquecinas. También puede aparecer como placas del mismo color de la mucosa adyacente o hasta áreas ligeramente deprimidas y enrojecidas. Si están disponibles, equipos de alta definición y cromoscopia son superiores a endoscopios de alta definición con luz convencional, ya que pueden dirigir las biopsias a áreas más representativas y con mayor riesgo de malignidad (Figura 1).
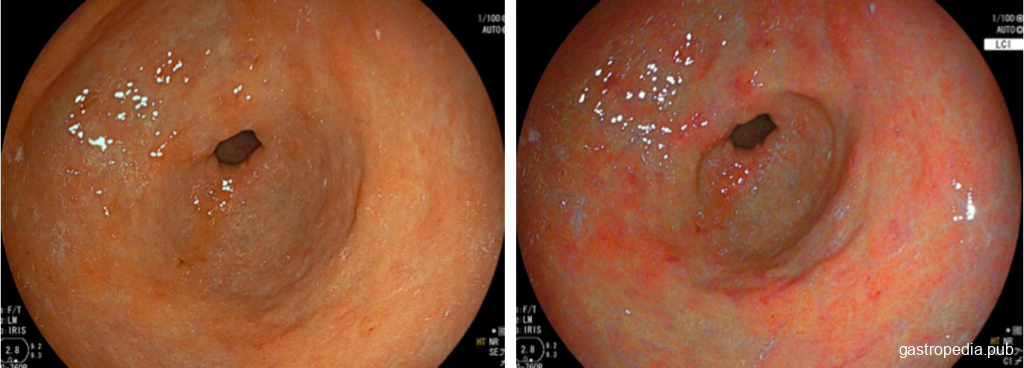
Metaplasia intestinal (MI) en antro gástrico. A la izquierda, examen bajo luz blanca y, a la derecha, examen con cromoscopia óptica (LCI), donde es más fácil reconocer la extensión de la MI.
De forma análoga a lo que tenemos para gastritis atrófica, también tenemos un sistema de clasificación para estadiamiento de la metaplasia, el Operative Link on Gastritis Assessment based on Intestinal Metaplasia (OLGIM). Para ello, son necesarias biopsias del antro (+ incisura) y del cuerpo gástrico (en la pequeña y en la gran curvatura de cada región), que deben ser identificadas en frascos separados (Figura 2). La endoscopia necesita ser de alta calidad para excluir etapas avanzadas de atrofia y metaplasia. En caso de lesiones sospechosas visibles, se deben realizar biopsias adicionales.
| Enlace operativo sobre la evaluación de metaplasia intestinal gástrica (OLGIM) |
CUERPO | ||||
| Sin MI (Puntaje 0) |
MI Leve (Puntaje 1) |
MI Moderada (Puntaje 2) |
MI Grave (Puntaje 3) |
||
| ANTRO / INCISURA |
Sin MI (Puntaje 0) |
Estadio 0 | Estadio 1 | Estadio 2 | Estadio 2 |
| MI leve (Puntaje 1) |
Estadio 1 | Estadio 1 | Estadio 2 | Estadio 3 | |
| MI moderada (Puntaje 2) |
Estadio 2 | Estadio 2 | Estadio 3 | Estadio 4 | |
| MI Grave (Puntaje 3) |
Estadio 3 | Estadio 3 | Estadio 4 | Estadio 4 | |
Sistema OLGIM para evaluación de metaplasia intestinal gástrica.
¿Cuál es el riesgo?
El adenocarcinoma gástrico tipo intestinal es el final de la famosa cascada de Pelayo Correa: inflamación –> atrofia –> metaplasia –> displasia –> carcinoma. Por lo tanto, tanto la gastritis atrófica como la metaplasia intestinal se consideran condiciones pre-cancerosas. Otra inferencia de esta cascada es que, si existe metaplasia intestinal gástrica, significa que también hay gastritis atrófica.
Uno de los mayores estudios de seguimiento poblacional identificó que la incidencia anual de cáncer gástrico en pacientes con MI era de 0,25%, con una incidencia acumulativa en 10 años de 2,4%. En Japón, donde la incidencia de cáncer gástrico es mayor, un estudio demostró una incidencia acumulativa mucho mayor: entre 5,3 y 9,8% en 5 años para MI.
Tener metaplasia intestinal gástrica no debe ser vista, por lo tanto, como una evolución obligatoria hacia el cáncer, sino como una oportunidad de vigilancia para, en caso de evolución hacia displasia o adenocarcinoma, poder realizar un diagnóstico y tratamiento tempranos.
¿Quiénes son los pacientes con metaplasia intestinal que presentan mayor riesgo de evolución hacia neoplasia?
- Extensión de la metaplasia intestinal: OLGIM III y IV. Se considera limitada si está restringida a una región del estómago y extensa si afecta a dos (antro y cuerpo).
- Historial familiar de cáncer gástrico: Aunque la mayoría de los cánceres gástricos son esporádicos, algún tipo de historial familiar ocurre en hasta un 10% de los casos. Tener un familiar de primer grado con cáncer gástrico aumenta el riesgo entre 2 y 10 veces. Se cree que este riesgo familiar no se debe solo a una susceptibilidad genética heredada, sino también a factores ambientales o de estilo de vida compartidos, así como al compartir la misma cepa citotóxica de H. pylori.
- Presencia de metaplasia intestinal incompleta: el riesgo de progresión a cáncer es hasta 11 veces mayor en comparación con la metaplasia intestinal completa. Histológicamente, la metaplasia intestinal completa se define por mucosa del tipo intestino delgado con células absorbentes maduras, células caliciformes y borde en cepillo. La metaplasia intestinal incompleta es similar al epitelio del colon con células columnares “intermedias” en varios estados de diferenciación.
- Gastritis atrófica autoinmune.
- Infección persistente por H. pylori, ya que no fue posible la erradicación a pesar de los intentos terapéuticos.
¿Cómo hacer seguimiento?
No existe un tratamiento específico para la metaplasia intestinal hasta el momento. Una vez diagnosticada, el enfoque es controlar los factores agresores (principalmente tratamiento de H. pylori, pero también cesar el tabaquismo y mejorar la dieta) y realizar vigilancia endoscópica en casos seleccionados que presenten mayor riesgo de evolución hacia el cáncer.
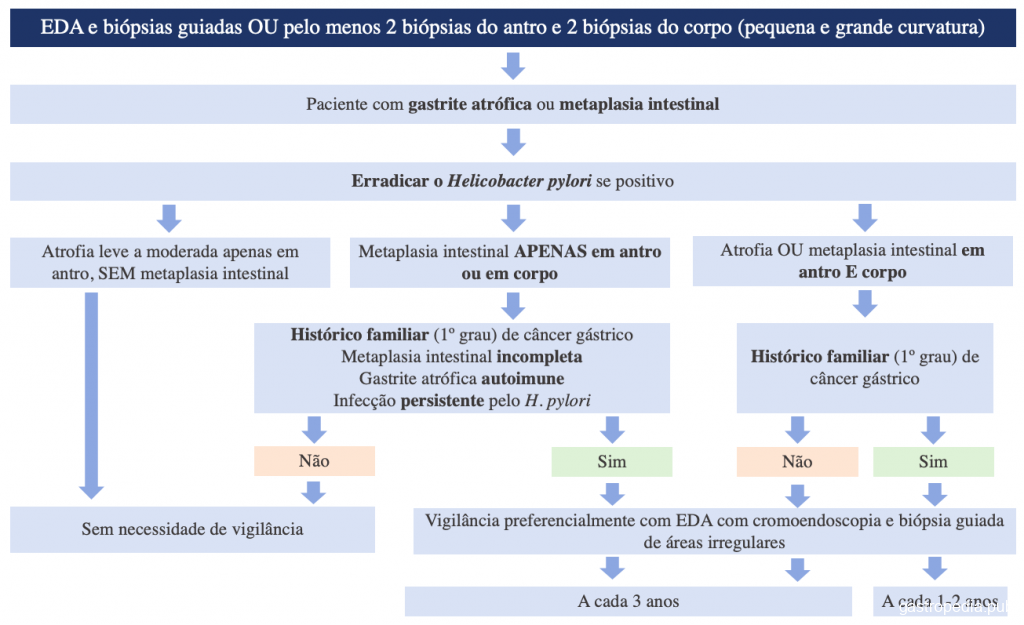
Uno de los principales flujogramas para guiar ese seguimiento es el Consenso MAPS II (Management of epithelial precancerous conditions and lesions in the stomach), que fue publicado en 2019 por la ESGE (Sociedad Europea de Endoscopia Gastrointestinal) y está resumido en la Figura 3.
Referencias
- Pimentel-Nunes P, Libânio D, Marcos-Pinto R, Areia M, Leja M, Esposito G, et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Port. Endoscopy 2019;51:365–88. doi:10.1055/a-0859-1883.
- Jencks DS, Adam JD, Borum ML, Koh JM, Stephen S, Doman DB. Overview of Current Concepts in Gastric Intestinal Metaplasia and Gastric Cancer. Gastroenterol Hepatol (N Y) 2018;14:92–101. doi:10.1111/j.1365-2559.1987.tb01893.x.
- Sugano K, Moss SF, Kuipers EJ. Gastric Intestinal Metaplasia: Real Culprit or Innocent Bystander as a Precancerous Condition for Gastric Cancer? Gastroenterology 2023;165:1352-1366.e1. doi:10.1053/j.gastro.2023.08.028.
- Gupta S, Li D, El Serag HB, Davitkov P, Altayar O, Sultan S, et al. AGA Clinical Practice Guidelines on Management of Gastric Intestinal Metaplasia. Gastroenterology 2020;158:693–702. doi:10.1053/j.gastro.2019.12.003.
- White JR, Banks M. Identifying the pre-malignant stomach: From guidelines to practice. Transl Gastroenterol Hepatol 2022;7:1–13. doi:10.21037/tgh.2020.03.03.
Cómo citar este artículo
Lages RB, Gamarra ACQ. Metaplasia intestinal gástrica: ¿cuál es el riesgo y qué hacer? Gastropedia 2024, vol. 1. Disponible en: gastropedia.pub/pt/gastroenterologia/metaplasia-intestinal-gastrica-qual-o-risco-e-o-que-fazer/


