Papel de los diferentes métodos diagnósticos en el abordaje de la enfermedad por reflujo gastroesofágico
Aunque la ERGE es una patología común, su diagnóstico puede ser desafiante, ya que los síntomas son inespecíficos, la presentación clínica es heterogénea y hay superposición con otros trastornos gastrointestinales.1,2 Como para muchos autores no hay un estándar de oro, el diagnóstico debe basarse en una combinación de varios factores, tales como presentación clínica, respuesta terapéutica, evaluación endoscópica y monitoreo prolongado del reflujo.3,4
El consenso de Lyon (publicado en 2018 y posteriormente actualizado en 2023) buscó orientar sobre las indicaciones de exámenes complementarios, y así definir criterios concluyentes para el diagnóstico de ERGE, conforme ya resumimos en publicación previa (haga clic aquí).5,6 En la Tabla 2, describimos las ventajas y desventajas de los principales métodos diagnósticos disponibles.
| Prueba diagnóstica | Comentarios | Ventajas | Desventajas |
| Historia clínica | Diagnóstico clínico presuntivo de ERGE puede ser establecido si síntomas típicos en pacientes sin signos de alarma | – Fácil utilización en la atención primaria – Sin costos |
– Sensibilidad y especificidad limitadas – Superposición de quejas con otras afecciones esofagogástricas |
| Prueba empírica de supresión ácida | Conducta posible desde los puntos de vista terapéutico y diagnóstico. Positivo si síntomas mejoran con uso de inhibidor de bombas de protones | – Fácil utilización en la atención primaria – Bajos costos |
– Sensibilidad y especificidad limitadas – Otras afecciones esofagogástricas también mejoran con supresión ácida |
| Endoscopia digestiva alta (EDA) | Debe ser realizada en pacientes con signos de alarma o síntomas refractarios | – Permite diagnóstico de esofagitis, hernia de hiato y complicaciones de la ERGE (sangrado, úlceras, estenosis, esófago de Barrett) – Permite diagnóstico diferencial – Elevada especificidad |
– Baja sensibilidad: 70% de los pacientes con ERGE sin tratamiento presentan mucosa normal (no-erosiva) – Examen invasivo – Costo elevado |
| pHmetría esofágica | Utiliza catéter transnasal (24h). No es necesaria de rutina. Importante en pacientes con síntomas refractarios o evaluación preoperatoria. | – Permite determinar exposición ácida esofágica anormal, frecuencia del reflujo y asociación entre síntomas y episodios de reflujo – Fácil de realizar – Análisis automático acurado |
– Incómodo para el paciente, que modifica el comportamiento del día a día – No se considera variación diaria – Requiere manometría esofágica |
| pHmetría esofágica sin cable | Utiliza cápsula sin cable | – No necesita del uso de catéter transnasal (más cómodo y con eso no modifica comportamientos del día a día) – Permite monitorización más prolongada (48-96h) – Análisis automático acurado |
– Requiere EDA para colocación de la cápsula – Algunos pacientes pueden presentar disfagia, necesitando de la retirada – La cápsula puede desplazarse precozmente – Alto costo y poca disponibilidad |
| Impedancio-pHmetría esofágica | Utiliza catéter transnasal (24h) | – Permite detección de reflujo no-ácido y aerofagia | – Incómodo para el paciente – No se considera variación diaria – Requiere manometría esofágica – Alto costo y poca disponibilidad – Análisis automático limitado |
| Manometría esofágica | Recomendada en la evaluación preoperatoria de la ERGE y en pacientes con queja de disfagia | – Identifica hipotonía de la unión esofagogástrica, hernia de hiato e hipomotilidad esofágica – Permite descartar otros trastornos motores del esófago, como acalasia |
– Incómodo para el paciente – No confirma el diagnóstico de ERGE |
Comentarios adicionales
a) Diagnóstico clínico
Pirosis y/o regurgitación son rutinariamente los síntomas más confiables para el diagnóstico clínico presuntivo de ERGE. Sin embargo, puede existir superposición de quejas con otras afecciones esofagogástricas, como gastroparesia, acalasia, pirosis funcional y esofagitis eosinofílica.2,3 Una revisión sistemática identificó que tales síntomas presentaban sensibilidad y especificidad, respectivamente, de 30-76% y 62-96% para la presencia de esofagitis erosiva.11
A su vez, la terapia empírica con IBP para pacientes con síntomas de ERGE sin signos de alarma es conducta posible tanto desde el punto de vista terapéutico como herramienta diagnóstica. Una respuesta positiva a la terapia de supresión ácida confirmaría la sospecha.3,12 Sin embargo, un metaanálisis previo sugirió limitaciones de este enfoque, con sensibilidad del 78% y especificidad del 54%.13
b) Endoscopia digestiva alta
La endoscopia digestiva alta (EDA) es generalmente el primer examen para investigación de ERGE, principalmente en pacientes con signos de alarma (disfagia, vómitos, pérdida ponderal, edad mayor que 50 años, anemia) o síntomas refractarios.8,14 Sin embargo, a pesar de presentar alta especificidad, la endoscopia tiene baja sensibilidad, pudiendo ser normal en dos tercios de los casos sin tratamiento.2,15
La EDA contribuye para diagnóstico de ERGE al identificar esofagitis, hernia de hiato y complicaciones (sangrado, úlceras, estenosis, esófago de Barrett), además de permitir descartar otros diagnósticos diferenciales, tales como malignidades, esofagitis eosinofílica y esofagitis infecciosa.7 La principal estandarización utilizada para definición de esofagitis erosiva (EE) es la clasificación de Los Ángeles, que evalúa la extensión de erosiones en esófago distal utilizando los siguientes criterios:16
- Grado A: Erosiones lineales no confluentes y menores que 5 mm;
- Grado B: Erosiones lineales no confluentes y mayores que 5 mm;
- Grado C: Erosiones confluentes que ocupan menos de 75% de la circunferencia esofágica;
- Grado D: Erosiones confluentes que ocupan más de 75% de la circunferencia esofágica;
No obstante, la esofagitis erosiva está presente en solo 30 a 40% de los pacientes con pirosis.5 En individuos en uso de IBP, ese hallazgo pasa a ser descrito en menos del 10% de las endoscopias.5,17 Un gran estudio de banco de datos identificó esofagitis en solo 17,3% de 280.075 endoscopias, siendo que 79% de ellas eran grados A o B de Los Ángeles.18 Además, existe variación interobservador en los casos de esofagitis erosiva grado A de Los Ángeles y este hallazgo puede estar presente en hasta 5,0 a 7,5% de individuos asintomáticos.5,19
Según el consenso de Lyon publicado inicialmente en 2018, solo esofagitis grados C y D de Los Ángeles, estenosis péptica y esófago de Barrett serían hallazgos confirmatorios de ERGE en la EDA.5 Posteriormente en 2022, tanto el consenso sobre ERGE de la American Gastroenterological Association (AGA) como del American College of Gastroenterology (ACG) sugirieron que esofagitis erosiva grado B de Los Ángeles asociada a síntomas típicos debería ser también considerada como hallazgo confirmatorio de ERGE.3,8 En esta misma dirección, la actualización 2.0 del consenso de Lyon (2023) también pasó a incluir pacientes con esofagitis erosiva grado B como evidencia concluyente para diagnóstico de ERGE, pues estudios de validación evidenciaron que estos casos presentan AET similar a aquellos con esofagitis grado C.6,20 Como fue expuesto, sin embargo, estas alteraciones endoscópicas no son frecuentes y, por eso, la sensibilidad de la EDA es considerada baja.2,18
c) Manometría esofágica
Aunque la manometría esofágica no diagnostica ERGE, tiene un papel central en la evaluación de esta patología, ya que evalúa la función motora de la JEG y la peristalsis del cuerpo esofágico, permitiendo descartar trastornos primarios de la motilidad esofágica.7,21 Además, permite la localización de la borda superior del EIE para orientar el posicionamiento adecuado del catéter de pHmetría.7
En la última década, la manometría de alta resolución (MAR) se ha vuelto más disponible en nuestro país.22,23 El catéter de la MAR presenta más sensores que la manometría convencional, registrando la presión esofágica sin lagunas significativas de los datos a lo largo de todo el esófago.21,24,25 Las presiones obtenidas se presentan en imágenes espacio-temporales de las presiones esofágicas codificadas por colores (clouse plots), con análisis visualmente intuitivo y simultáneo de la faringe al estómago, conforme presentado en la Figura 3.25
En relación a la manometría convencional, la MAR permite la localización más fácil e inmediata de los hitos anatómicos, haciendo el test más rápido, menos incómodo para el paciente por el tiempo reducido de examen, menos susceptible a la variabilidad interobservador y más fácil de interpretar y compensar los artefactos de movimientos.23,26
d) pHmetría esofágica
La pHmetría esofágica prolongada permite la comprobación de la presencia de reflujo gastroesofágico patológico.27 A pesar de su utilidad, es un examen incómodo y debe ser reservado para casos en que los síntomas no responden adecuadamente a la terapia empírica con IBP. Cuando aún no haya confirmación diagnóstica por los hallazgos de la EDA (EE grados B, C y D de Los Ángeles, Barrett largo o estenosis péptica), debe realizarse tras la suspensión de terapia supresora ácida por al menos 7 días.5,8 También debe realizarse antes de procedimientos quirúrgicos, pues es un importante predictor de buena respuesta terapéutica.3
Clásicamente, se realiza mediante un catéter introducido vía transnasal con uno o más sensores de pH. Se posiciona el sensor distal 5 cm por encima de la borda superior del EIE, previamente identificado por manometría. El reflujo ácido se define como caída del pH esofágico por debajo de 4.27–29 El porcentaje de tiempo de pH < 4 durante el tiempo total se denomina tiempo de exposición ácida total (AET, sigla ya consagrada para acid exposure time) e es la medidas más confiable para el diagnóstico de ERGE.5
Dependiendo de la referencia utilizada, el límite superior de normalidad de la AET se considera entre el 3,7 y el 5,8%.28 Buscando una mayor estandarización, el consenso de Lyon acordó en 2018 que los valores de AET por encima del 6% son confirmatorios de ERGE y por debajo del 4% excluyen esta diagnóstico. Por lo tanto, el rango del 4 al 6% se definió como una “zona gris” que depende de evidencia auxiliar para confirmar la ERGE (vide publicação do Consenso de Lyon clicando aqui).5,10
A pHmetria também pode ser realizada sem cateter, utilizando-se cápsula sem fio que é fixada à mucosa esofágica durante endoscopia, 6 cm acima da JEG.30 Desta forma, o paciente não tem desconforto do cateter transnasal e passa a tolerar melhor o exame, permitindo um período mais prolongado de monitorização (até 96 horas). No entanto, o custo elevado acaba limitando o uso desta técnica.8
La pHmetria también se puede realizar sin catéter, mediante el uso de una cápsula inalámbrica que se fija a la mucosa esofágica durante la endoscopia, 6 cm por encima de la unión esófagogástrica (UEG).30 De esta forma, el paciente no siente molestias por el catéter transnasal y comienza a tolerar el examen mejor, permitiendo un período más largo de seguimiento (hasta 96 horas). Sin embargo, el costo elevado acaba limitando el uso de esta técnica.8
e) Impedâncio-pHmetria:
Para mais detalhes, clique aqui.
Referências
- Jobe BA, Richter JE, Hoppo T, Peters JH, Bell R, Dengler WC, et al. Preoperative Diagnostic Workup before Antireflux Surgery: An Evidence and Experience-Based Consensus of the Esophageal Diagnostic Advisory Panel. J Am Coll Surg. 2013;217(4):586–97.
- Vaezi MF, Sifrim D. Assessing Old and New Diagnostic Tests for Gastroesophageal Reflux Disease. Gastroenterology. 2018;154(2):289–301.
- Katz PO, Dunbar KB, Schnoll-Sussman FH, Greer KB, Yadlapati R, Spechler SJ. ACG Clinical Guideline for the Diagnosis and Management of Gastroesophageal Reflux Disease. Am J Gastroenterol. 2022;117(1):27–56.
- Maret-Ouda J, Markar SR, Lagergren J. Gastroesophageal Reflux Disease. JAMA. 2020;324(24):2536–47.
- Gyawali CP, Kahrilas PJ, Savarino E, Zerbib F, Mion F, Smout A, et al. Modern diagnosis of GERD: the Lyon Consensus. Gut. 2018;67(7):1351–62.
- Gyawali CP, Yadlapati R, Fass R, Katzka D, Pandolfino J, Savarino E, et al. Updates to the modern diagnosis of GERD: Lyon consensus 2.0. Gut. 2023;gutjnl-2023-330616.
- Fisichella PM, Andolfi C, Orthopoulos G. Evaluation of Gastroesophageal Reflux Disease. World J Surg. 2017;41(7):1672–7.
- Yadlapati R, Gyawali CP, Pandolfino JE, Chang K, Kahrilas PJ, Katz PO, et al. AGA Clinical Practice Update on the Personalized Approach to the Evaluation and Management of GERD: Expert Review. Clin Gastroenterol Hepatol. 2022 May;20(5):984–94.
- Kavitt RT, Vaezi MF. New Diagnostic Tests for GERD. In: The Esophagus. Wiley; 2021. p. 208–17
- Zerbib F. Diagnosis of GORD: is the ‘grey area’ expanding? Gut. 2021;70(12):2221–2.
- Moayyedi P, Talley NJ, Fennerty MB, Vakil N. Can the Clinical History Distinguish Between Organic and Functional Dyspepsia? JAMA. 2006 Apr 5;295(13):1566–76.
- Vaezi MF, Pandolfino JE, Vela MF, Shaheen NJ. White Paper AGA: Optimal Strategies to Define and Diagnose Gastroesophageal Reflux Disease. Clin Gastroenterol Hepatol. 2017/03/28. 2017;15(8):1162–72.
- Numans ME, Lau J, de Wit NJ, Bonis PA. Short-term treatment with proton-pump inhibitors as a test for gastroesophageal reflux disease: a meta-analysis of diagnostic test characteristics. Ann Intern Med. 2004;140(7):518–27
- Fass R. Gastroesophageal Reflux Disease. N Engl J Med. 2022;387(13):1207–16.
- Muthusamy VR, Lightdale JR, Acosta RD, Chandrasekhara V, Chathadi K V, Eloubeidi MA, et al. The role of endoscopy in the management of GERD. Gastrointest Endosc. 2015;81(6):1305–10
- Lundell LR, Dent J, Bennett JR, Blum AL, Armstrong D, Galmiche JP, et al. Endoscopic assessment of oesophagitis: Clinical and functional correlates and further validation of the Los Angeles classification. Gut. 1999;45(2):172–80.
- Zagari RM, Fuccio L, Wallander MA, Johansson S, Fiocca R, Casanova S, et al. Gastro-oesophageal reflux symptoms, oesophagitis and Barrett’s oesophagus in the general population: the Loiano-Monghidoro study. Gut. 2008;57(10):1354–9.
- Wang A, Mattek NC, Holub JL, Lieberman DA, Eisen GM. Prevalence of complicated gastroesophageal reflux disease and Barrett’s esophagus among racial groups in a multi-center consortium. Dig Dis Sci. 2009;54(5):964–71.
- Yadlapati R. Clinical Spectrum and Diagnosis of GERD Phenotypes. In: The Esophagus. Wiley; 2021. p. 333–46.
- Rusu RI, Fox MR, Tucker E, Zeki S, Dunn JM, Jafari J, et al. Validation of the Lyon classification for GORD diagnosis: acid exposure time assessed by prolonged wireless pH monitoring in healthy controls and patients with erosive oesophagitis. Gut. 2021;70(12):2230–7.
- Queiroz NSF. Parâmetros da manometria de alta resolução para avaliação da junção esofagogástrica e suas relações com o padrão de refluxo avaliado por monitorização prolongada. Faculdade de Medicina da Universidade de São Paulo; 2017.
- Domingues GR, Michelsohn NH, Viebig RG, Chinzon D, Nasi A, Andrade CG, et al. Normal values of esophageal high-resolution manometry: A Brazilian multicenter study. Arq Gastroenterol. 2020;57(2):209–15.
- da Silva RMB, Herbella FAM, Gualberto D. Normative values for a new water-perfused high resolution manometry system. Arq Gastroenterol. 2018;55(Suppl 1):30–4.
- Domingues GR, Moraes-Filho JPP. Gastroesophageal reflux disease: a practical approach. Arq Gastroenterol. 2021;58(4):525–33.
- Yadlapati R, Kahrilas PJ, Fox MR, Bredenoord AJ, Prakash Gyawali C, Roman S, et al. Esophageal motility disorders on high‐resolution manometry: Chicago classification version 4.0 ©. Neurogastroenterol Motil. 2021 Jan 29;33(1):e14058.
- Tack J, Pauwels A, Roman S, Savarino E, Smout A, Akyuz F, et al. European Society for Neurogastroenterology and Motility (ESNM) recommendations for the use of high-resolution manometry of the esophagus. Neurogastroenterol Motil. 2021;33(5):1–14.
- Herbella FAM, Nipominick I, Patti MG. From sponges to capsules. The history of esophageal pH monitoring. Dis Esophagus. 2009;22(2):99–103.
- Kim GH. How to Interpret Ambulatory 24 hr Esophageal pH Monitoring. J Neurogastroenterol Motil. 2010;16(2):207–10.
- Fontes LHS, Navarro-Rodriguez T. Esofagomanometria e pHmetria esofágica: Guia prático. 1st ed. São Paulo: Editora Atheneu; 2012. 176 p.
- Nasi A, Queiroz NSF, Michelsohn NH. Prolonged gastroesophageal reflux monitoring by impedance-pHmetry: a review of the subject pondered with our experience with 1,200 cases. Arq Gastroenterol. 2018;55(Suppl 1):76–84.
Como citar este artigo
Lages RB, Gamarra ACQ. Papel dos diferentes métodos diagnósticos na abordagem da doença do refluxo gastroesofágico Gastropedia 2024, vol. 2. Disponível en: https://gastropedia.pub/es/gastroenterologia/papel-de-los-diferentes-metodos-diagnosticos-en-el-abordaje-de-la-enfermedad-por-reflujo-gastroesofagico/
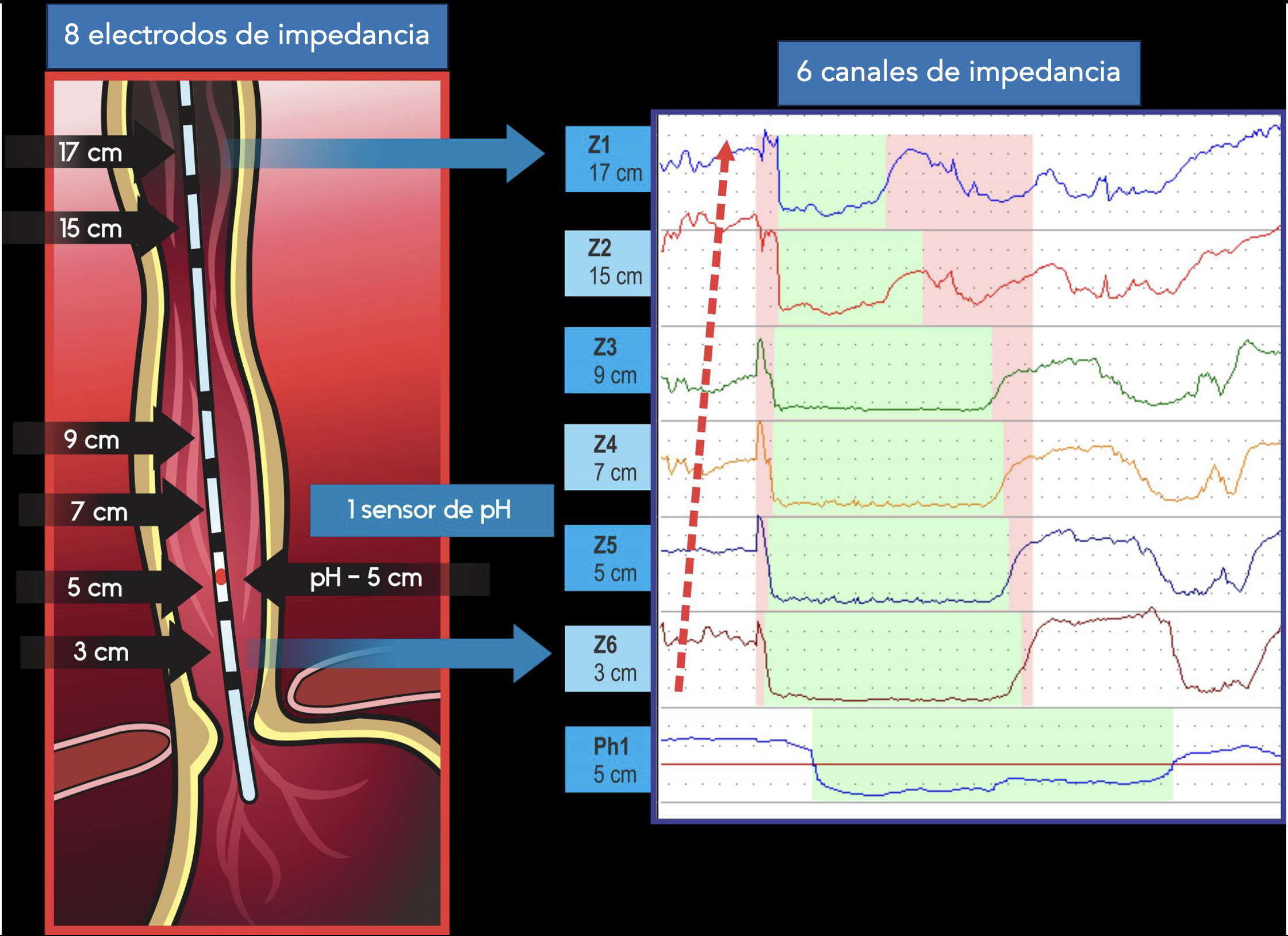
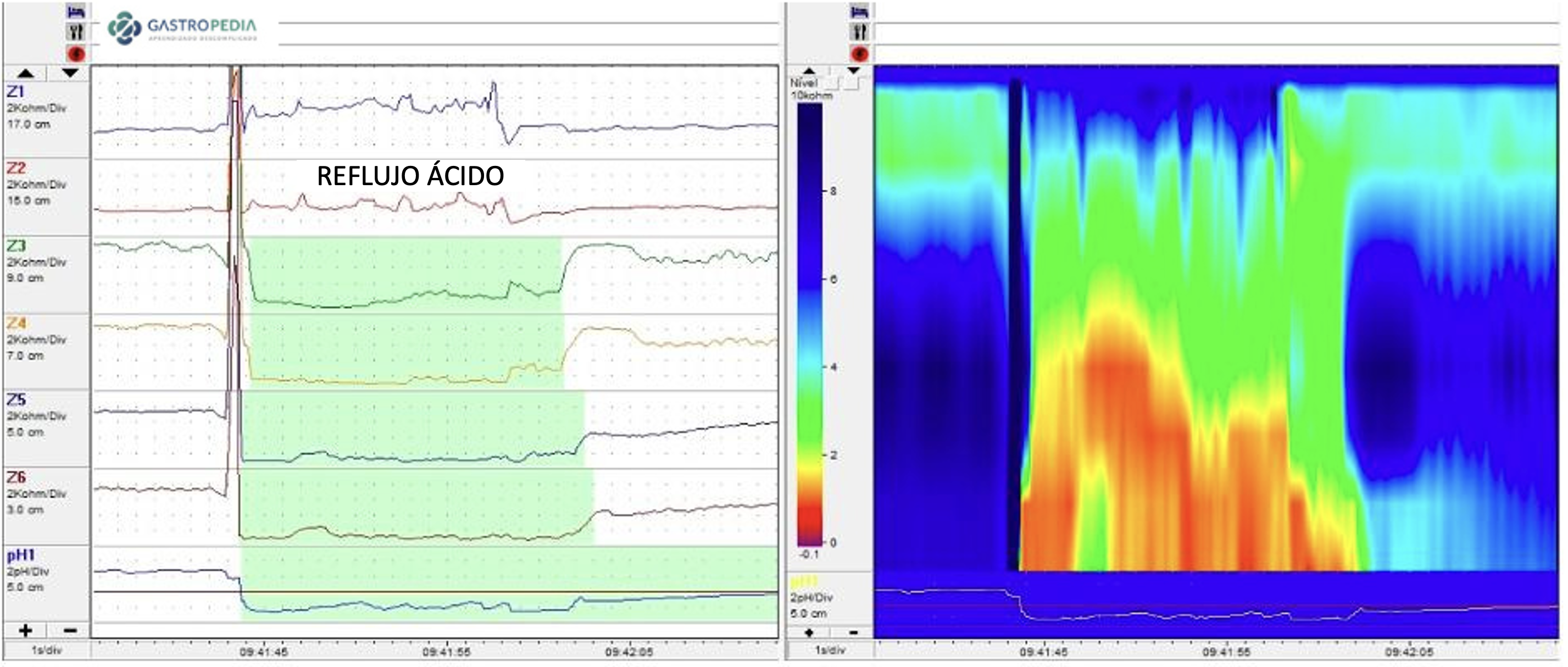
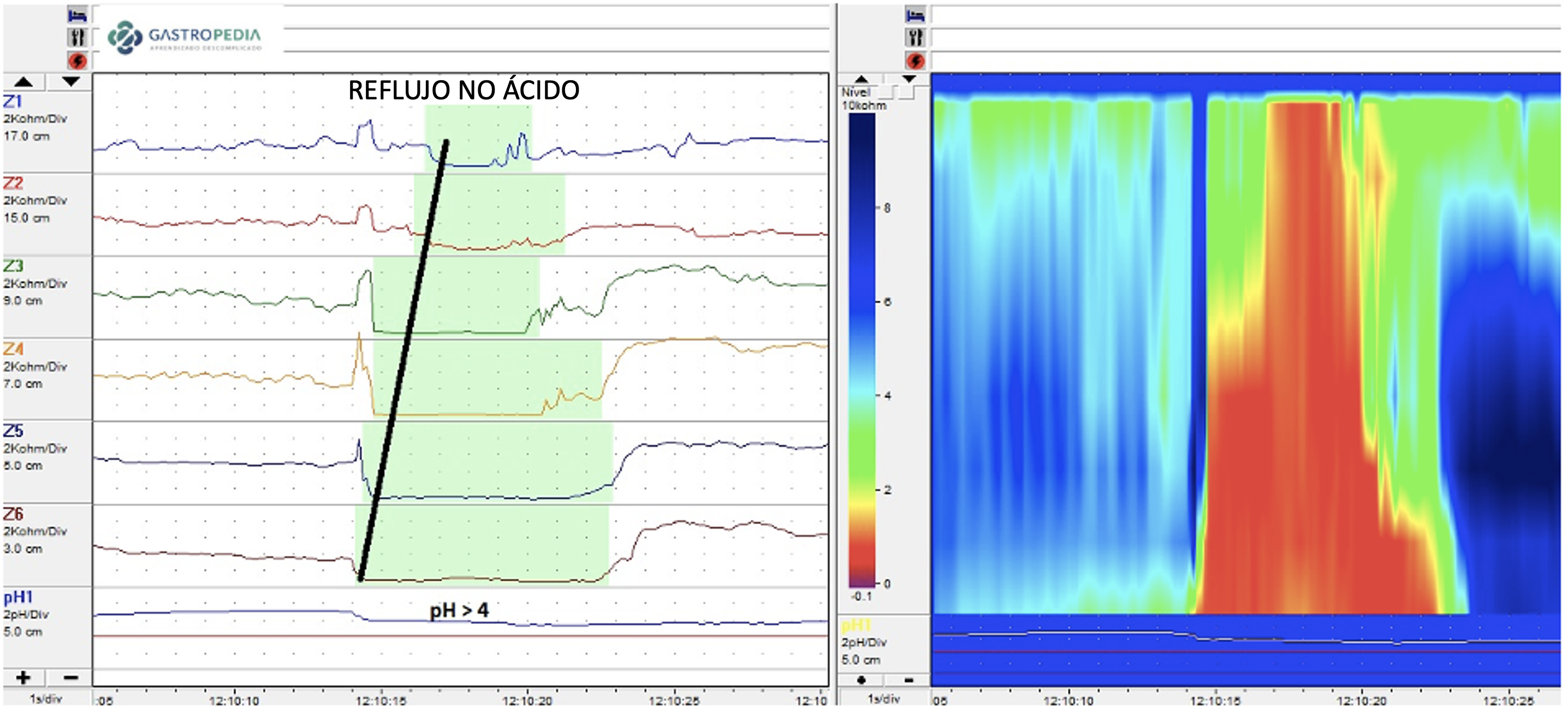
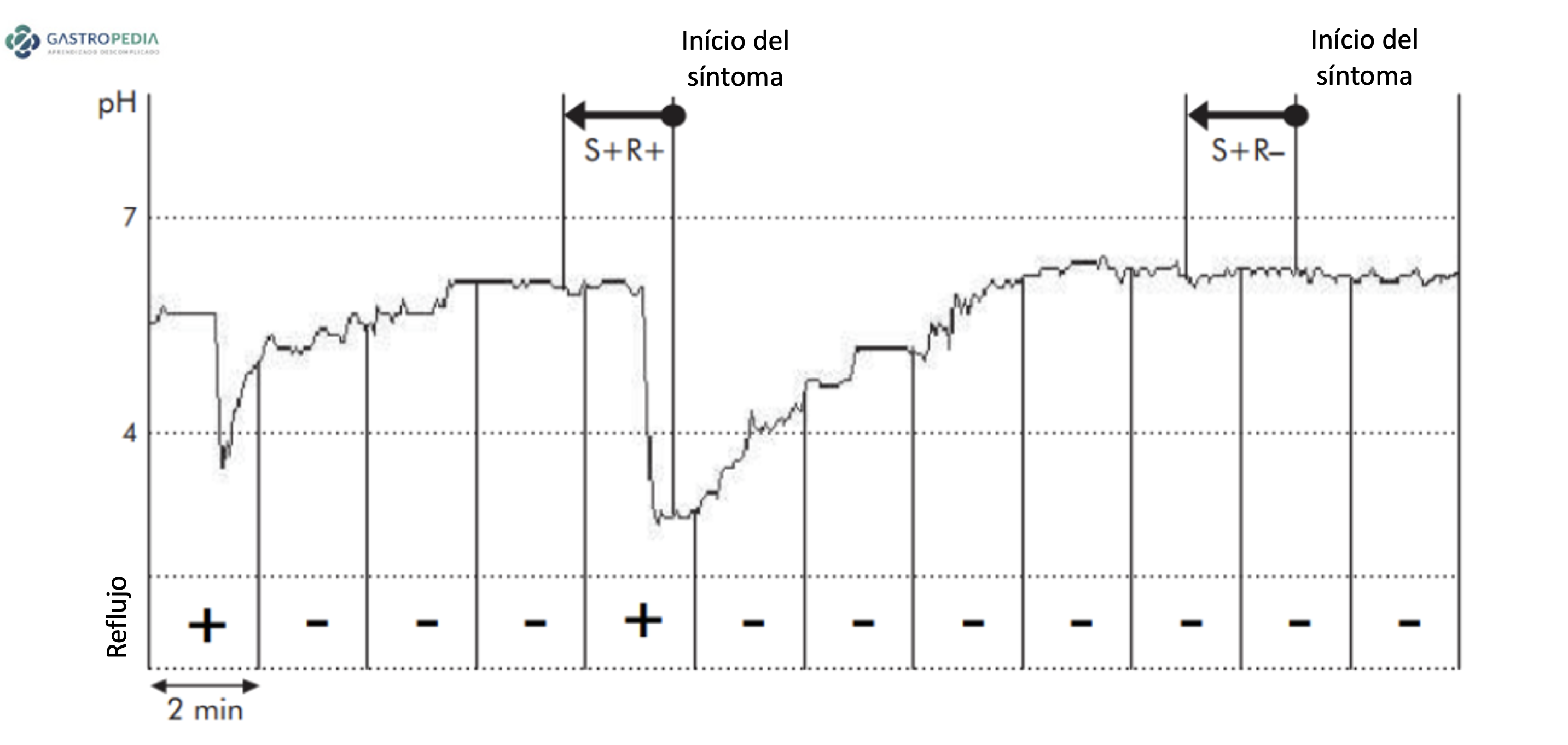

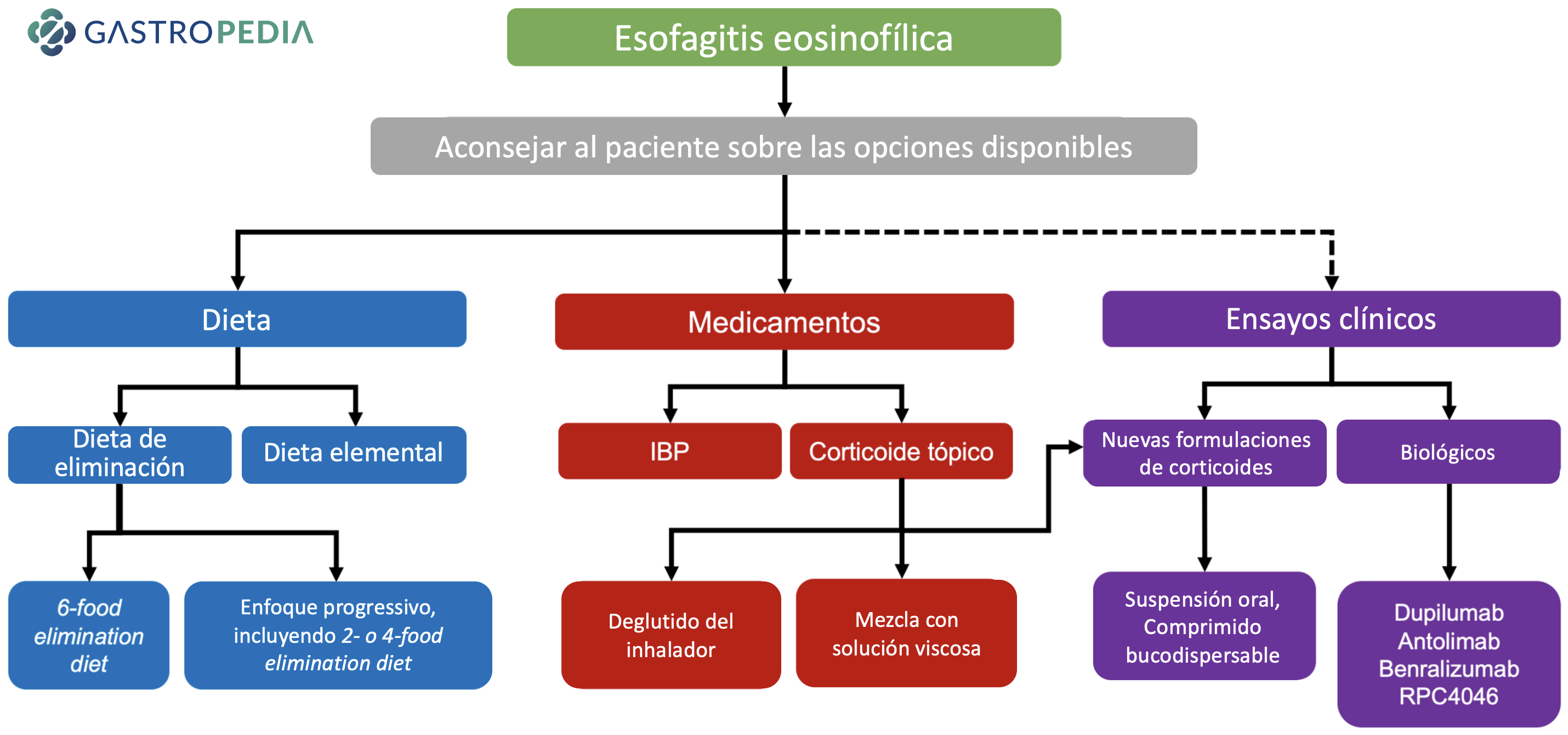 Figura 1: Diagrama de flujo de opciones para el tratamiento de la esofagitis eosinofílica. En el contexto apropiado, también puede ser necesaria la dilatación endoscópica. Adaptado de Beveridge & Falk (2020)[1]
Figura 1: Diagrama de flujo de opciones para el tratamiento de la esofagitis eosinofílica. En el contexto apropiado, también puede ser necesaria la dilatación endoscópica. Adaptado de Beveridge & Falk (2020)[1]





