Enfermedad diverticular del colon: epidemiología y fisiopatología
1. INTRODUCCIÓN
La enfermedad diverticular del colon es una patología donde se forman pequeños sacos por una protrusión generalmente en el punto de penetración de la arteria nutriente (vasa recta) que irriga la mucosa y la submucosa. Es una enfermedad crónica con un amplio espectro de síntomas abdominales que eventualmente pueden agudizarse.
La enfermedad diverticular del colon afecta a más de la mitad de los individuos mayores de 60 años. Sin embargo, solo el 20% de los pacientes desarrollan síntomas de esta condición.
Existe un amplio espectro de presentaciones clínicas de los divertículos de colon. El detalle del cuadro clínico se discutirá en otro artículo. En este artículo, nos centraremos en la fisiopatología de la enfermedad diverticular y sus complicaciones. Sin embargo, es importante entender la diferencia de nomenclaturas utilizadas para describir cada condición. Resumidamente:
- Diverticulosis o Enfermedad diverticular asintomática: es la simple presencia de divertículos en el colon. Puede ser asintomática o sintomática. La mayoría de las personas con divertículos del colon permanecen asintomáticas. Los síntomas atribuidos a la diverticulosis aparecen en aproximadamente el 25-30% de los individuos. Algunos autores reservan el término enfermedad diverticular solo para la diverticulosis sintomática, aunque en nuestro medio estos términos se usan como sinónimos.
- Enfermedad diverticular sintomática puede variar según su presentación clínica, desde la Enfermedad diverticular sintomática no complicada, que típicamente se manifiesta por dolor abdominal localizado, sensación de gases y alteraciones del hábito intestinal, hasta la Enfermedad diverticular complicada, como la diverticulitis aguda y la hemorragia diverticular.
2. EPIDEMIOLOGÍA
La enfermedad diverticular es una de las desórdenes gastrointestinales más comunes en los países occidentales, y se cree que su incidencia tiende a aumentar, siendo proporcional con el envejecimiento de la población. La diverticulosis del colon es el hallazgo más común en la colonoscopia. La distribución de estos divertículos varía con la raza, pero no con el sexo. En occidente, el 80-90% se sitúan en el colon izquierdo. En la población asiática la diverticulosis predomina en el colon derecho (80%). La frecuencia de diverticulosis a la derecha ha aumentado en occidente últimamente. La prevalencia de la diverticulosis es menor que el 20% en la población menor de 40 años, comparado con cerca del 60% en los individuos con más de 70 años de edad. La diverticulosis generalmente cursa sin síntomas a lo largo de la vida. La diverticulitis aguda ocurre en menos del 5% de los pacientes con diverticulosis y de estos, el 20% tendrán diverticulitis complicada. Después de la recuperación del primer episodio, el 15 a 20% pueden presentar recurrencia.
3. FISIOPATOLOGÍA
El mecanismo fisiopatológico involucrado en la enfermedad diverticular es complejo y no está completamente comprendido. La diverticulosis parece estar ligada a la formación de divertículos a través de altas presiones en la mucosa del colon en lugares de debilidad donde las arteriolas penetran la capa muscular circular para suministrar nutrientes a la mucosa. Estas arteriolas provienen de colaterales de las arterias mesentérica superior e inferior a través del arco de Riolan, de la arteria marginal de Drummond y una serie de otros arcos. Los arcos terminales finalmente penetran la capa muscular por la vasa recta para formar el plexo submucoso. Así, las contracciones de elevada amplitud asociadas a la obstipación y el elevado contenido de grasa en las heces en el lumen del colon sigmoide resultan en la creación de estos divertículos. Los divertículos ocurren más frecuentemente en el colon sigmoide estando relacionados a la presión y el tipo de contenido intraluminal.
¿Divertículo falso o verdadero? En la población occidental, los divertículos son causados por la inversión de las capas mucosa y submucosa, pero no de la capa muscular, por lo tanto, se denominan falsos divertículos o pseudodivertículos. En la población oriental, la inversión puede involucrar todas las capas de la pared del colon y estos divertículos son, por lo tanto, referidos como divertículos “verdaderos”.
Existen tres factores principales involucrados en la fisiopatología de la enfermedad diverticular:
- Alteraciones de la pared del colon
- Aumento de la presión intracólica (dismotilidad)
- Dieta pobre en fibras (heces endurecidas)
3.1 Alteraciones en la pared:
Existe un engrosamiento atribuido a la deposición de elastina entre las células musculares en la taenia, verificándose un aumento de la síntesis de colágeno tipo III. Esto lleva a un acortamiento de las tenias colónicas con engrosamiento de la capa muscular circular y reducción del calibre del órgano, proceso conocido como myochosis coli. Se verifica una expresión acentuada del inhibidor tisular de metaloproteinases, que regula la deposición de proteínas en la matriz extracelular, lo que podría llevar al aumento de la elastina y colágeno. Estos hallazgos parecen estar en armonía con la incidencia más alta de la diverticulosis en las enfermedades del tejido conjuntivo.
- Varios autores refieren engrosamiento de la capa muscular como factor que precede al divertículo, ya que esta hipertrofia causaría aumento de la presión intracolónica y aumento del número de ondas motoras.
3.2 Trastornos de la motilidad del colon:
- Según Painter (TEORÍA DE LA SEGMENTACIÓN NO-PROPULSIVA) (Painter NS, et al. Gastroenterology. 1965), el colon actúa en segmentos separados en lugar de funcionar como un tubo continuo. Si se produce progresión de esta segmentación, las altas presiones se dirigen a la pared del colon en lugar de desarrollar ondas de propulsión para mover el contenido intestinal distalmente.
- Postuló la teoría de la segmentación cólica donde la contracción de la musculatura lisa en sintonía con las pliegues semilunares de la mucosa llevaría al aparecimiento de múltiples cámaras (que corresponderían a las haustraciones) donde la presión estaría aumentada favoreciendo la pulsión de la mucosa contra los puntos de debilidad en la pared cólica en la entrada de los vasos rectos llevando entonces al aparecimiento de los divertículos.
- La actividad mioeléctrica también parece estar alterada en la enfermedad. Se demostró en varios estudios más recientes que en la enfermedad diverticular existen menos células de Cajal y células gliales y una variabilidad en la expresión de ciertos neuropéptidos
- Las alteraciones de la motilidad cólica resultan en aumento de las presiones de reposo en el colon de individuos con enfermedad diverticular.
- El colon sigmoide por tener la mayor presión en el colon y ser el segmento más estrecho es el más afectado.
- La observación de presiones elevadas de reposo e inducidas en el colon derecho de pacientes asiáticos con divertículos proximales también fue publicada, sugiriendo que la dismotilidad proximal también juega un papel en el origen de los divertículos del colon derecho.
3.3 Dieta:
- La gran variación en la prevalencia de esta afección, así como su estrecha correlación con la dieta occidental sugieren la existencia de un factor etiológico presente en la dieta.
- Painter y Burkitt (Painter NS and Burkitt DP. Brit Medical.1971) observaron en más de 1.200 habitantes del Reino Unido y de Uganda que los primeros, consumiendo una dieta occidental pobre en fibra y refinada (masa fecal diaria de aproximadamente 110 gramos), exhibían un tiempo de tránsito intestinal menor que los africanos que se alimentaban de una dieta rica en fibras y tenían una masa fecal evaluada en aproximadamente 450 gramos por día. Se postuló que los tiempos de tránsito intestinal prolongados con heces poco voluminosas resultantes de una dieta pobre en fibras llevarían a un aumento significativo de la presión intraluminal y predispondrían a la formación de divertículos.
- Sin embargo, cuando observamos a una población enteramente occidental, tales diferencias en la composición de la dieta y en la duración del tiempo de tránsito no fueron esclarecedoras. Tampoco están disponibles estudios de intervención para comprobar la evidencia epidemiológica.
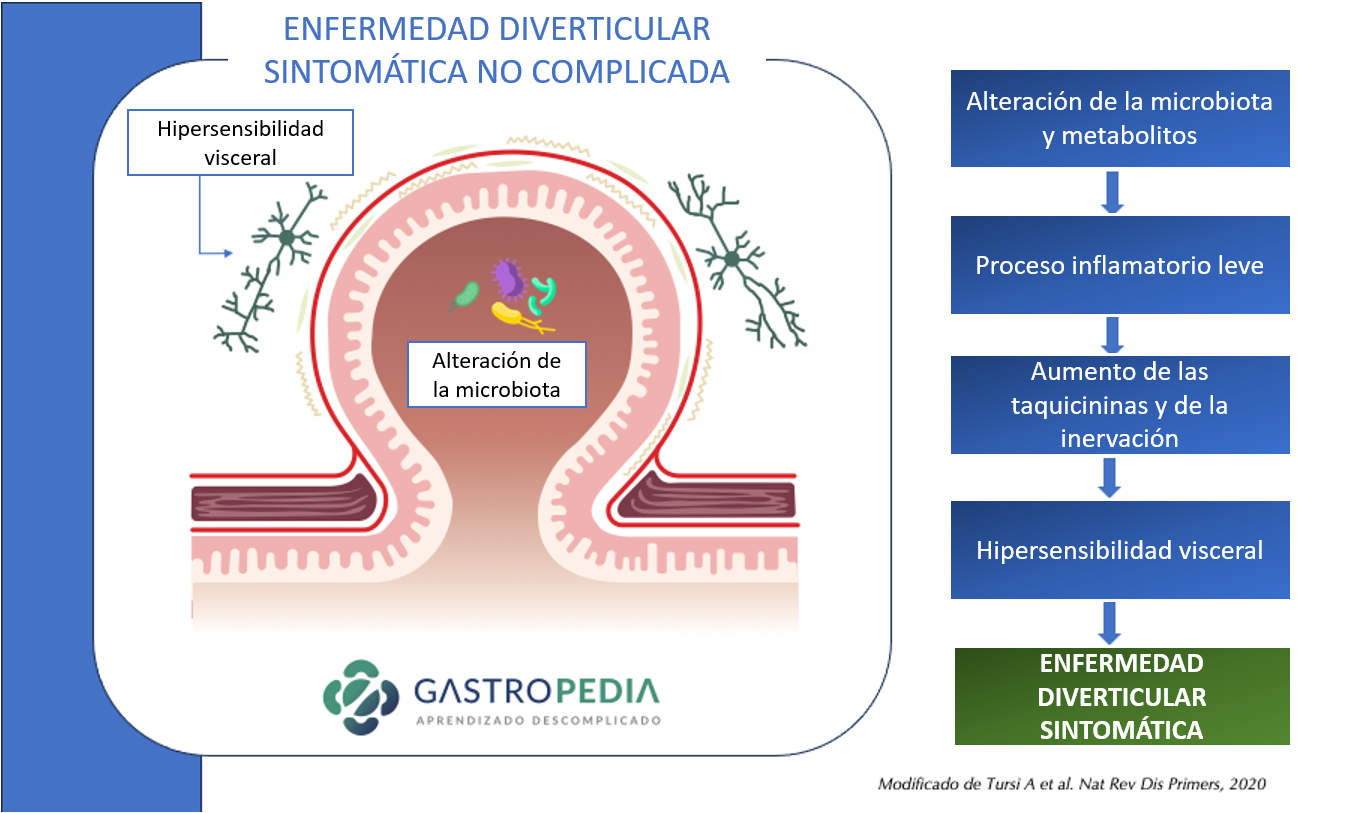
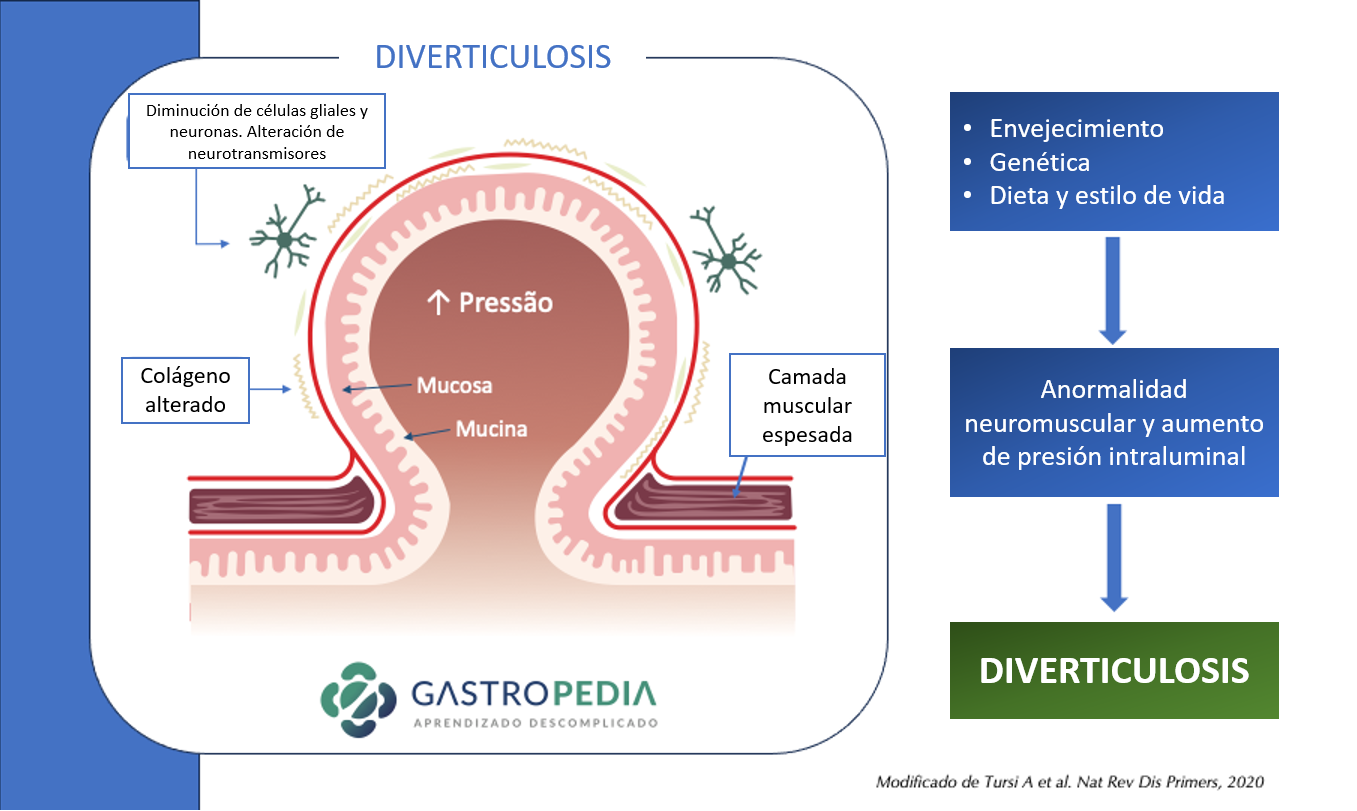 La principal hipótesis para la diverticulosis involucra anormalidades neuromusculares, con alteración en la composición del colágeno, en el sistema neuronal entérico, en un escenario de aumento de la presión intraluminal.
La principal hipótesis para la diverticulosis involucra anormalidades neuromusculares, con alteración en la composición del colágeno, en el sistema neuronal entérico, en un escenario de aumento de la presión intraluminal.
La enfermedad diverticular sintomática no complicada puede ocurrir en un contexto de microbiota alterada, dando lugar a un proceso inflamatorio crónico e insidioso, con liberación de mediadores inflamatorios e hipersensibilidad visceral.
4.1 Fisiopatologia de la diverticulitis aguda
La causa subyacente de la diverticulitis es la perforación microscópica o macroscópica de un divertículo. Los mecanismos que conducen a esta perforación no están bien dilucidados y la causa probablemente sea multifactorial. Anteriormente, se creía que la obstrucción de los divertículos (p. ej., por fecalitos) aumentaba la presión intradiverticular y causaba perforación. Sin embargo, esta obstrucción no siempre está presente.
Se cree que el proceso es multifactorial:
- Alteración de la microbiota que conduce a una disfunción de la barrera mucosa
- Inflamación crónica local
- Traumatismo local con erosión de la pared diverticular por aumento de la presión intraluminal y fecalitos.
- Siguen inflamación y necrosis focal, lo que resulta en perforación.
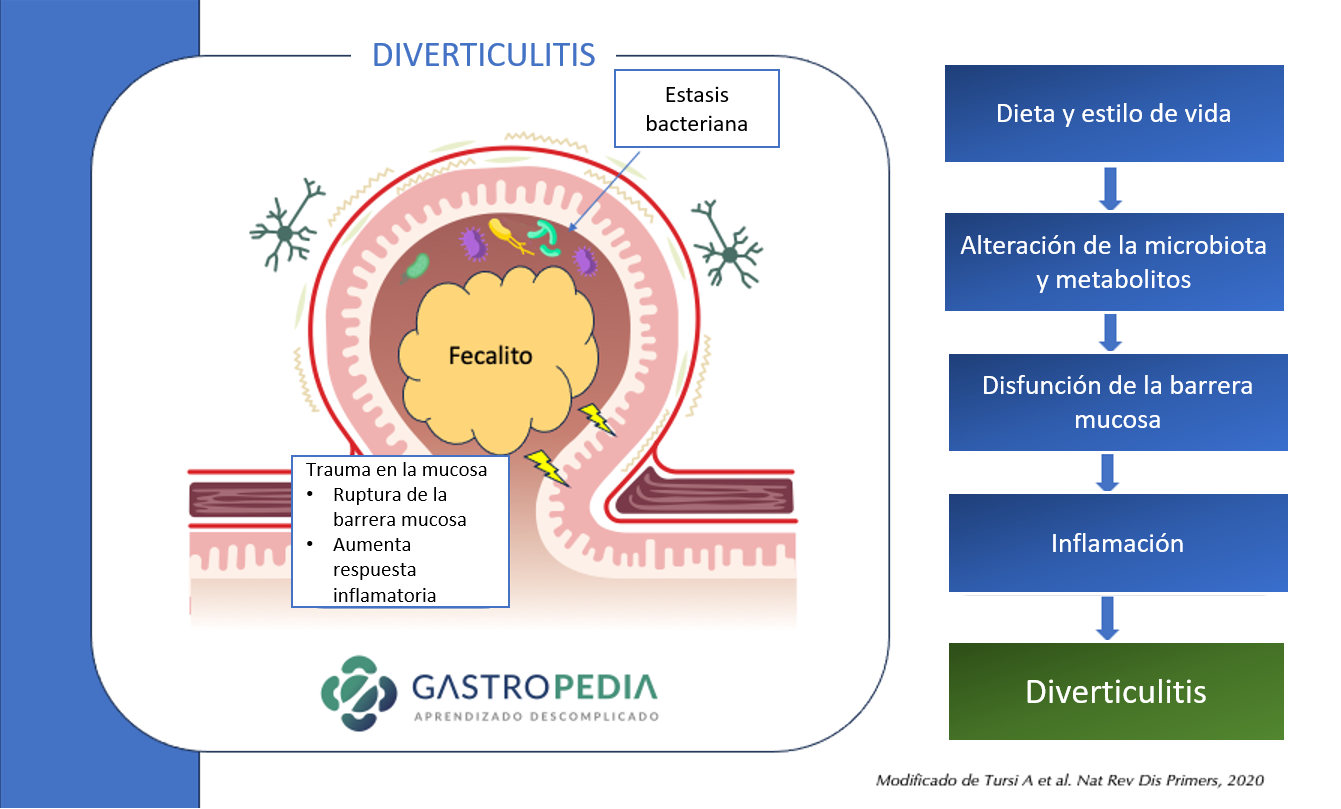 Los cambios en la microbiota, la pérdida de la función barrera, la inflamación y el traumatismo provocado por el fecalito son los principales mecanismos propuestos para la diverticulitis aguda.
Los cambios en la microbiota, la pérdida de la función barrera, la inflamación y el traumatismo provocado por el fecalito son los principales mecanismos propuestos para la diverticulitis aguda.4.2 Fisiopatologia del sangramento diverticular
En cuanto a la fisiopatología del sangrado diverticular, después de la hernia diverticular en el punto de debilidad del vaso, los vasos rectos están más expuestos al contenido del colon, lo que lleva al engrosamiento de la capa íntima y al adelgazamiento de la capa media, lo que predispone a la ruptura hacia la luz.
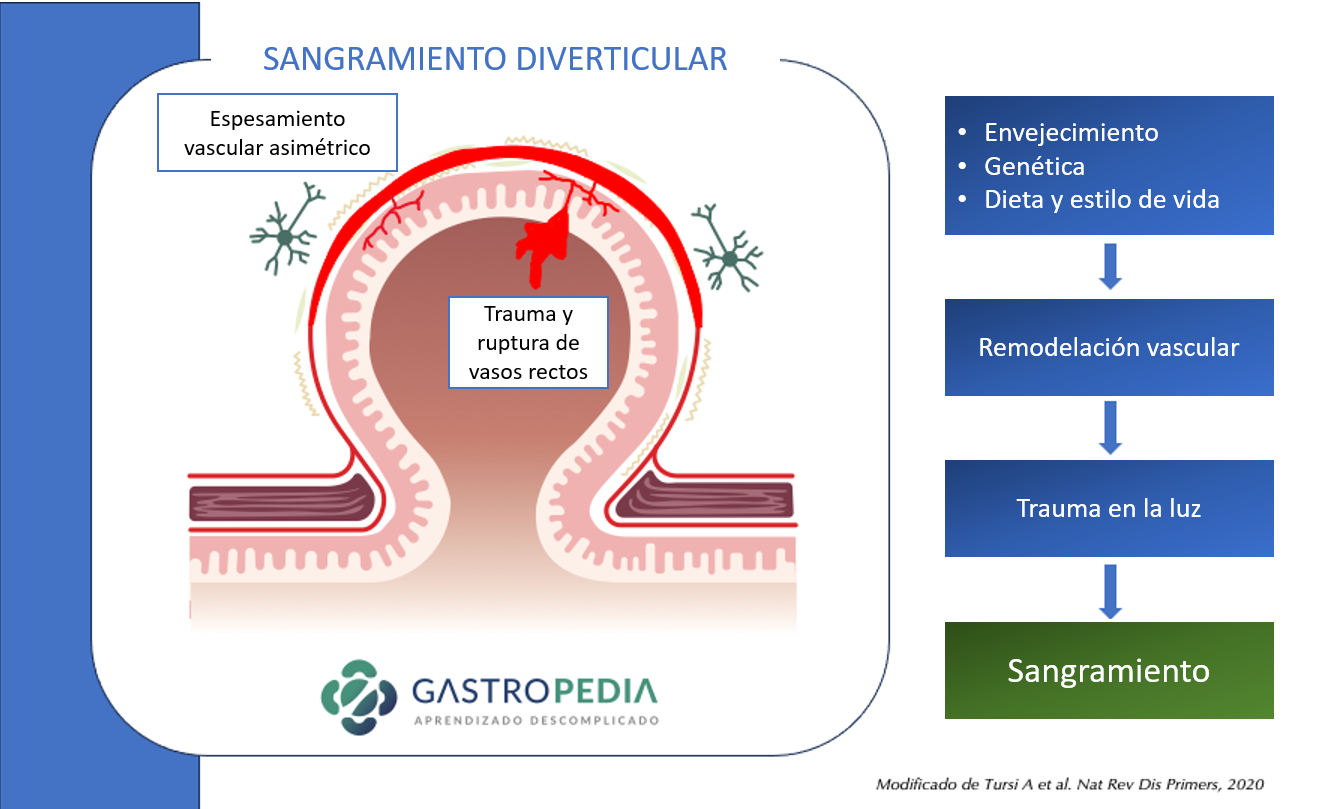 El sangrado diverticular ocurre en lugares con asimetría de vasos perforantes de mayor calibre. La obesidad, la hipertensión arterial y el trauma luminal se consideran factores de riesgo de hemorragia diverticular.
El sangrado diverticular ocurre en lugares con asimetría de vasos perforantes de mayor calibre. La obesidad, la hipertensión arterial y el trauma luminal se consideran factores de riesgo de hemorragia diverticular.
5. FATORES DE RIESGO
Varios factores de riesgo ya se han correlacionado con la enfermedad diverticular, incluida la ingesta de carnes rojas, una dieta baja en fibra, la inactividad física, un IMC > 25 kg/m2 y el tabaquismo. Todas las directrices situan la obesidad, la dieta pobre en fibra y el sedentarismo como factores de riesgo de la enfermedad diverticular.
REFERENCIAS
Tursi A, Scarpignato C, Strate LL, Lanas A, Kruis W, Lahat A, Danese S. Colonic diverticular disease. Nat Rev Dis Primers. 2020 Mar 26;6(1):20. doi: 10.1038/s41572-020-0153-5. PMID: 32218442
Como citar esta publicación
Martins BC, Penaloza CSQ. Enfermedad diverticular del colon: epidemiología y fisiopatología. En Gastropedia 2023, vol 1. Disponible en: https://gastropedia.pub/es/?p=8062&preview=truehttps://gastropedia.pub/pt/cirurgia/doenca-diverticular-do-colon-epidemiologia-e-fisiopatologia