Megacolon Chagásico: fisiopatología y cuadro clínico
Definición
El término megacolon se caracteriza por la dilatación y alargamiento del intestino grueso, fundamentalmente debido a alteraciones de la inervación intrínseca de esa víscera, con los consiguientes trastornos morfológicos y funcionales.
Etiología y fisiopatología
En Brasil y en varios países de América del Sur, la principal etiología del megacolon es la enfermedad de Chagas (EC), también llamada Tripanosomiasis Americana, causada por la transmisión del Trypanosoma cruzi a través de insectos triatominos hematófagos (Barbeiro), llamados de vectores.
Frecuentemente las manifestaciones son tardías debido a la destrucción irreversible de células ganglionares periféricas del sistema nervioso autónomo, principalmente el parasimpático, a través de los plexos mioentérico y submucoso (Auerbach y Meissner).
Las alteraciones en la denervación en la región rectosigmoide y en el colon ocurren fundamentalmente en la fase aguda de la infección por Trypanossoma cruzi y dependen del equilibrio entre el huésped y el parásito que involucra diversos factores de la compleja reacción del sistema inmunológico.
Sin embargo, estudios más recientes demuestran la participación en el megacolon chagásico (MC) también de las células intersticiales de Cajal, que son originarias del mesodermo y están presentes en el plexo mioentérico en las capas longitudinales y circulares del colon. Sin embargo, aún es incierto si las alteraciones en estas células son primarias o secundarias en la fisiopatología del MC. En nuestro medio, Araújo et al. demostraron una reducción significativa de estas células en especímenes quirúrgicos comparando portadores de MC y pacientes sin EC (p<0,001).
Macroscopia y alteraciones en el colon
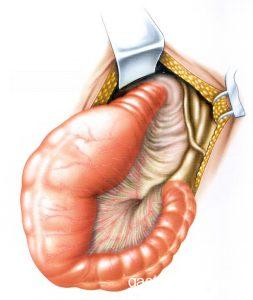
El lugar de acalasia, disinergia y mayor denervación autonómica en el MC es la porción distal del sigmoides y proximal del recto (transición rectosigmoide), aunque puede ocurrir en todo el colon. En las vísceras huecas la destrucción de células ganglionares provoca, con el paso del tiempo, la aparición de dilataciones, hipertrofias musculares y alargamientos, con mayores repercusiones en el colon izquierdo (notablemente en el sigmoides) debido al hecho de que esta región acomoda el bolo fecal ya en forma sólida (Figura 1). Consecuentemente, hay alteraciones de secreción, absorción y motilidad cólica.
Epidemiología
La manifestación clínica de la EC ocurre más comúnmente en la 4ª y 5ª década de vida, con prevalencia ligeramente mayor en pacientes del sexo masculino (60%). Afecta a cerca de 18 millones de personas en América del Sur y cerca de 120 millones de latinoamericanos están en riesgo de contraer la enfermedad. Sin embargo, se observa una caída acentuada de los casos después de la década de los 90, principalmente por la mejora de las condiciones de vida y saneamiento básico, pero también por el éxodo rural y uso de insecticidas.
Así, actualmente se observa que la EC y el MC afectan predominantemente a personas mayores y esto demuestra la complejidad y necesidad de individualización de conducta y plan terapéutico en esta población. En un estudio brasileño, con análisis de 90 portadores de EC, se observó que el promedio de otras enfermedades concomitantes fue de 2,8 ± 1,8 y que casi el 18% de los pacientes necesitaron hospitalización en el año anterior, principalmente por descompensación de enfermedad cardíaca y el 75% tenían más de 67 años de edad.
Formas de transmisión:
- triatominos contaminados
- transfusión sanguínea
- transplante de órganos
- contaminación vertical
- contaminación por vía oral a través de alimentos
Locales de afección
- 46,7% corazón
- 30% mixta
- 13,3% TGI:
- 58.3% esófago
- 16,7% colon
- 25% ambos
- 10% otros órganos
La investigación de los órganos afectados por la EC es de fundamental importancia ya que la miocardiopatía se constituye tanto en principal causa de muerte como en factor contribuyente para la misma. Además, en el caso de enfermedad esofágica, la existencia de desnutrición es frecuente, también colaborando para el aumento de la morbilidad y mortalidad de estos pacientes.
Cuadro clínico
Cerca del 30-60% de los portadores de EC presentarán síntomas relacionados con la enfermedad y de estos, el 7-10% tendrán quejas relacionadas con el tracto digestivo, siendo la colopatía la que tiene manifestación más tardía.
El principal síntoma del portador de MC es el estreñimiento intestinal crónico con empeoramiento progresivo a lo largo del tiempo. Cerca del 70% de los pacientes con MC se quedan sin evacuar por más de 10 días y el 37% por más de 20 días. De esta forma, aunque pueda haber síntomas de obstrucción de salida asociados, o disinergia, la principal característica de estos pacientes es el largo tiempo sin el deseo de evacuar (diferente de los pacientes con obstrucción de salida clásica, que habitualmente presentan el deseo eventualmente varias veces al día). Sin embargo, es importante resaltar que, como las heces son resacas habitualmente, y hay disinergia de la musculatura anorrectal, es común el relato de esfuerzo evacuatorio y dificultad en eliminarlas a lo largo del tiempo para la exoneración.
El meteorismo también es un síntoma bastante común y puede venir acompañado por reducción de la ingesta alimentaria no solo por la distensión abdominal, sino también por el exceso de heces en el colon y también, no infrecuentemente, como relato de los pacientes que evitan ingerir alimentos para no acumular heces. Sin embargo, esa reducción de la cantidad de alimentación necesita ser bien diferenciada de la disfagia consecuente de la acalasia del esófago.
Al examen físico, se puede constatar:
- signos de desnutrición
- distensión abdominal
- aumento del timpanismo en el espacio de Traube
- desplazamiento del colon sigmoides hacia el abdomen derecho
- signo de Gersuny: palpación moldeable del hipogastrio y fosa ilíaca izquierda (FII) con sensación de desprendimiento al relajar, debido a acumulación de heces en el colon izquierdo (fecaloma).
Además, es primordial en todas las consultas, la realización del tacto rectal, ya que la incidencia de fecaloma en portadores de MC a lo largo de la vida es alrededor del 50%.
Complicaciones:
- impactación fecal y formación de fecaloma
- úlcera estercorácea: se deriva de la acción mecánica de la impactación fecal en la pared intestinal con formación de área de isquemia. Ocurre en cerca del 3% de los casos de MC.
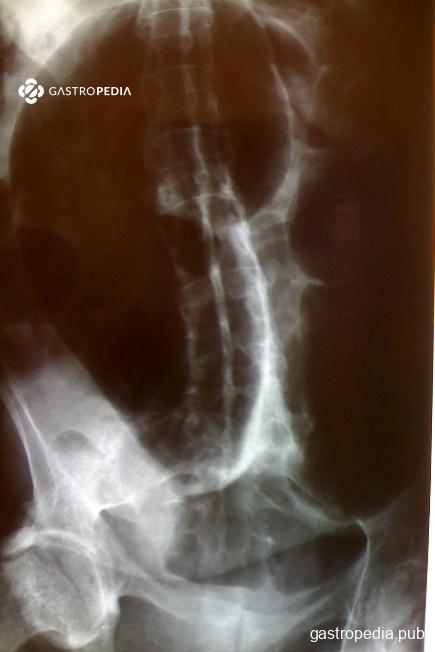
- volvo de sigmoides: cuadro agudo de importante distensión abdominal, parada de eliminación de heces y gases, y vómitos, provocada por alargamiento crónico del mesocolon debido a la dilatación del lumen y distensión por heces, con rotación organoaxial aguda. El signo radiológico clásico es el del grano de café (Figura 2).
Referencias
- Santos Júnior JCM. Megacólon – Parte II: Doença de Chagas. Rev Bras Coloproct, 2002(4):266-277
- Alves RMA, Thomaz RP, Almeida EA, Wanderley JS, Guariento ME. Chagas’ disease and ageing: the coexistence of other chronic diseases with Chagas’ disease in elderly patients. Revista da Sociedade Brasileira de Medicina Tropical. 2009; 42(6):622-8
- Nahas SC, Dias AR, Dainezi MA, Araújo SEA, Nahas CSR. A Vídeo-Cirurgia no Tratamento do Megacólon Chagásico. Rev bras Coloproct, 2006;26(4): 470-4
- Kamiji MM, Oliveira RB. O perfil dos portadores de doença de Chagas, com ênfase na forma digestiva, em hospital terciário de Ribeirão Preto, SP. Revista da Sociedade Brasileira de Medicina Tropical. 2005; 38(4):305-9
- Araújo SEA, Dumarco RB, Rawet V, Seid VE, Bocchini SF, Nahas SC. Depopulation of intersticial cells of Cajal in chagasic megacolon: towards tailored surgery? Arq Bras Cir Dig. 2010;32(2):81-5
- Silva AL, Giacomin RT, Quirino VA, Miranda ES. Proposta de classificação do megacólon chagásico através de enema opaco. Rev Col Bras Cir. 2003;30(1):4-10
- Cavenaghi S, Felicio OCS, Ronchi LS, Cunrath GS, Melo MMC, Netinho JG. Prevalence of rectoanal inhibitory reflex in chagasic megacolon. Arq Gastroenterol. 2008;45(2):128-31
- Nahas SC. Tratamento cirúrgico do megacólon chagásico pela retossigmoidectomia abdominal com anastomose mecânica colorretal término-lateral posterior imediata. Tese Professor Livre Docente, USP, São Paulo, 2000.
- Nahas SC, Pinto RA, Dias AR, Nahas CSR, Araújo SEA, Marques CFS, Cecconello I. Long-term follow up of abdominal rectosigmoidectomy with posterior end-to-side stapled anastomosis for Chagas megacolon. Olorectal Dis. 2011;13(3):317-22.
Cómo citar este artículo
Pinto RA, Neto IJFC, Camargo MGM, Nahas SC, Marques CFS, Gamarra ACQ. Megacolon Chagásico: fisiopatología y cuadro clínico Gastropedia 2025, Vol. 2 Disponible en: https://gastropedia.pub/es/cirugia/megacolon-chagasico-fisiopatologia-y-cuadro-clinico/