Adenomiomatosis de la Vesícula Biliar
Introducción
La adenomiomatosis o adenomiosis (ADM) es una condición benigna de la vesícula biliar caracterizada por el crecimiento excesivo de la mucosa, engrosamiento de la pared muscular y presencia de divertículos intramurales, conocidos como senos de Rokitansky-Aschoff (RAS).
En este artículo revisaremos las características patológicas, epidemiológicas y de diagnóstico de la adenomiomatosis, haciendo un breve comentario sobre el tratamiento.
Epidemiología
La adenomiomatosis es relativamente común, encontrándose en el 1-9% de las muestras de colecistectomía. Aunque puede ocurrir en una amplia gama de edades, los diagnósticos más frecuentes son en pacientes en sus 50 años. La incidencia aumenta con la edad, probablemente debido a la inflamación prolongada.
La prevalencia de la adenomiomatosis en relación al género varía en la literatura. Algunos estudios indican que es más común en mujeres (3:1), mientras que otros afirman que la prevalencia es similar entre hombres y mujeres. No se conoce ninguna preferencia racial.
La causa de la adenomiomatosis es desconocida, aunque se cree que es una respuesta a la inflamación crónica de la vesícula biliar. Como los diagnósticos más frecuentes ocurren en personas de alrededor de 50 años, la idea de la inflamación crónica como etiología parece plausible.
Hallazgos Patológicos
La adenomiomatosis es una de las colecistosis hiperplásicas, siendo la otra la colesterolosis. En esta condición, ocurre hiperplasia de la pared con la formación de senos de Rokitansky-Aschoff (divertículos intramurales revestidos por epitelio mucoso) que penetran en la pared muscular de la vesícula biliar, con o sin engrosamiento de la pared. La acumulación de colesterol en la adenomiomatosis es intraluminal, ya que los cristales de colesterol precipitan en la bilis retenida en los senos de Rokitansky.
 Figura 1. Los senos de Rokitansky-Aschoff consisten en invaginaciones del epitelio en la capa muscular que producen pequeños divertículos intramurales. Por sí sola, esta condición no tiene significado clínico. Un diagnóstico histológico de adenomiomatosis requiere que los senos de Rokitansky-Aschoff sean profundos, ramificados y acompañados de hipertrofia de la capa muscular.
Figura 1. Los senos de Rokitansky-Aschoff consisten en invaginaciones del epitelio en la capa muscular que producen pequeños divertículos intramurales. Por sí sola, esta condición no tiene significado clínico. Un diagnóstico histológico de adenomiomatosis requiere que los senos de Rokitansky-Aschoff sean profundos, ramificados y acompañados de hipertrofia de la capa muscular.
Fuente: Sleisenger and Fordtran’s Gastrointestinal and liver disease 9th ed p 1146 – 1149
Existen tres formas macroscópicas de adenomiomatosis (Fig. 2):
- La forma segmentaria (> 60%): forma una especie de diafragma entre el cuello y el fondo de la vesícula biliar, separándola en dos zonas comunicantes.
- La forma localizada (30%): generalmente ocurre en el fondo de la vesícula.
- La forma difusa (más rara <5%): engrosamiento parietal que afecta toda la pared de la vesícula.

Figura 2. Formas macroscópicas de la adenomiomatosis
En el tipo localizado, la adenomiomatosis puede causar un engrosamiento mucoso focal en la pared de la vesícula formando un nódulo, generalmente en el fondo, que se proyecta hacia el lumen, dando la apariencia de un pólipo en la ecografía. La capa muscular en el área afectada suele estar engrosada de tres a cinco veces su espesor normal.
Cuadro Clínico
Generalmente, la adenomiomatosis es asintomática y se descubre incidentalmente en estudios de imagen o después de una colecistectomía, aunque puede presentar síntomas. En raras ocasiones, puede causar dolor tipo cólico biliar en el hipocondrio derecho. Sin embargo, dado que la mitad de los casos de ADM están asociados a cálculos biliares, es difícil atribuir específicamente a la ADM la causa de dicho dolor.
No hay evidencia de que la presencia de adenomiomatosis aumente el riesgo de cáncer de vesícula biliar. Sin embargo, su presencia se ha asociado a casos más avanzados de cáncer vesicular, posiblemente porque dificulta el diagnóstico precoz mediante estudios de imagen.
Diagnóstico Radiológico
Dado que la ADM no presenta síntomas específicos, la imagenología cumple un papel fundamental en su diagnóstico diferencial. Aproximadamente el 25% de los casos de engrosamiento de la pared vesicular (pared > 3 mm) se deben a ADM.
Actualmente, el diagnóstico se basa en la ecografía y con frecuencia es incidental. La ecografía tiene una sensibilidad de aproximadamente 65%.
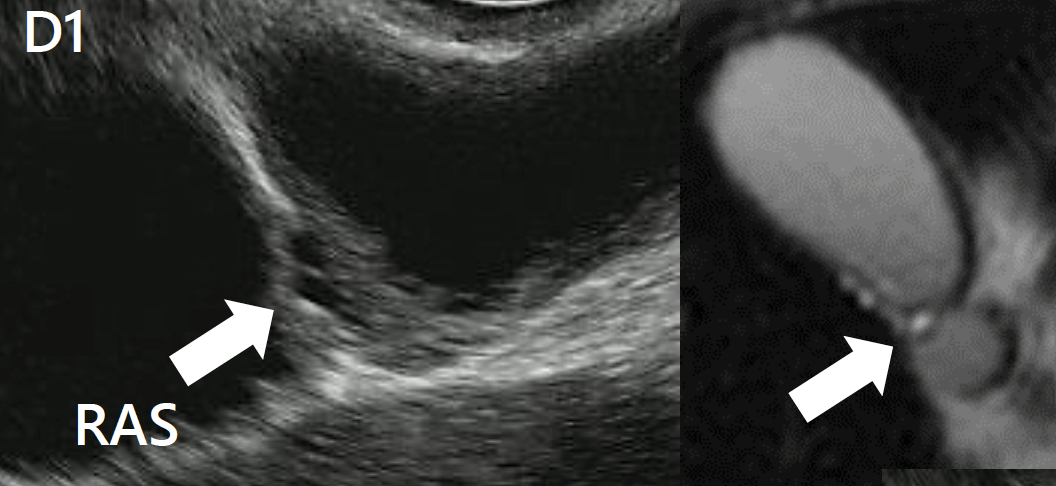
Los signos sugestivos incluyen engrosamiento de la pared, contenido luminal anecoico o ecogénico (lodo biliar, cálculos), imágenes pseudocísticas en la pared correspondientes a los senos de Rokitansky-Aschoff y artefactos de reverberación acústica (“cola de cometa”) debido a concreciones de calcio atrapadas en los RAS.
La ecografía endoscópica mejora la sensibilidad de la ecografía transabdominal, especialmente para el diagnóstico diferencial con cáncer de vesícula biliar.
Ecografía
-
Engrosamiento mural (difuso, focal, anular)
-
La forma segmentaria es especialmente difícil de distinguir del carcinoma vesicular
-
Artefacto de “cola de cometa”: focos intramurales ecogénicos de los que emanan artefactos de reverberación en forma de V, altamente específicos de la adenomiomatosis, representando cristales de colesterol en los senos de Rokitansky-Aschoff
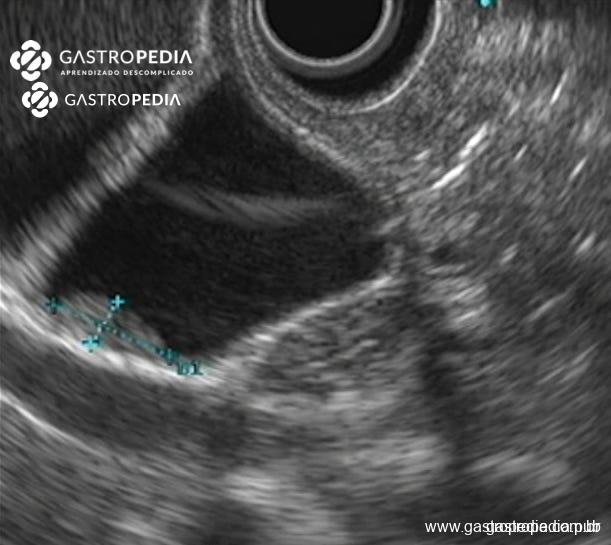
Engrosamiento segmentario hipoecoico en el fondo de la vesícula biliar, de 11×5 mm, sugestivo de adenomiomatosis. Imagen cedida por la Dra. Julia Mayumi Gregorio.
Tomografía Computarizada (TC)
-
Engrosamiento anormal de la pared de la vesícula biliar y realce mural son características comunes, aunque no específicas, de la TC para adenomiomatosis
-
Los senos de Rokitansky-Aschoff más grandes pueden visualizarse
-
Se ha descrito un signo de rosario en TC, formado por epitelio realzado dentro de divertículos intramurales rodeados por una capa muscular hipertrófica relativamente no realzada
Resonancia Magnética (RM)
La colangiopancreatografía por resonancia magnética (CPRM) es la técnica habitualmente empleada para la caracterización de la vesícula biliar y la vía biliar. Las características de imagen incluyen:
-
Engrosamiento mural
-
Masa focal sésil
-
Divertículos intramurales llenos de líquido
-
El signo de “collar de perlas” se refiere a la disposición curvilínea característica de múltiples cavidades intramurales redondeadas e hiperintensas visualizadas en imágenes ponderadas en T2
-
Configuración en “reloj de arena” en los tipos anulares
Tratamiento
Los pacientes con características típicas de adenomiomatosis en la ecografía no requieren vigilancia ni colecistectomía.
La colecistectomía puede estar indicada en las siguientes situaciones:
-
Paciente sintomático con dolor en el cuadrante superior derecho (generalmente debido a cálculos biliares)
-
Apariencia (especialmente cuando es focal) que puede ser difícil de distinguir de una malignidad
Referências
- Golse N, Lewin M, Rode A, Sebagh M, Mabrut JY. Gallbladder adenomyomatosis: Diagnosis and management. J Visc Surg. 2017 Oct;154(5):345-353. doi: 10.1016/j.jviscsurg.2017.06.004. Epub 2017 Aug 24. PMID: 28844704.
- Ryu Y, Abdeldjalil B, Molinari A, et al. Adenomyomatosis of the gallbladder. Reference article, Radiopaedia.org (Accessed on 24 Aug 2023) https://doi.org/10.53347/rID-7056
- Wisam F Zakko, MD. Gallbladder polyps. Disponível em https://www.uptodate.com/contents/gallbladder-polyps
Cómo citar este artículo:
Martins BC.; Gamarra ACQ. Adenomiomatosis da Vesícula Biliar Gastropedia 2025; vol 1. Disponible en: https://gastropedia.pub/es/cirugia/adenomiomatosis-de-la-vesicula-biliar/
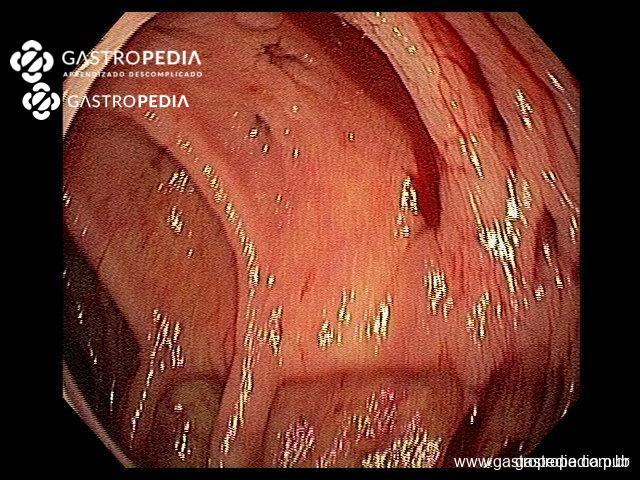
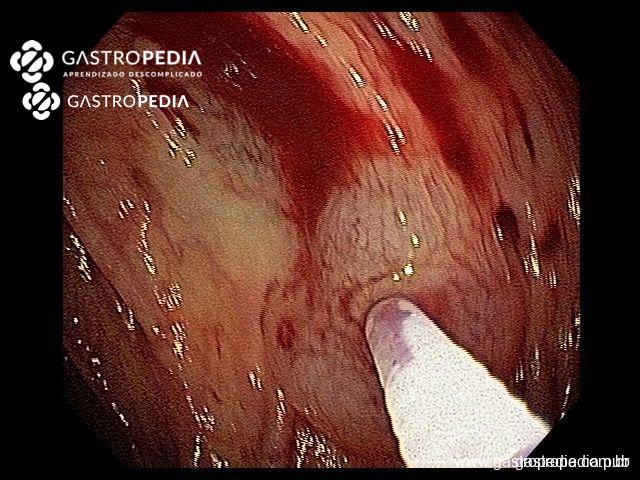
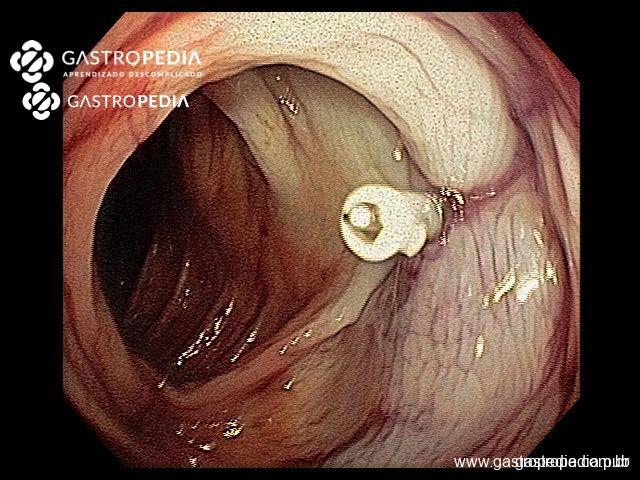
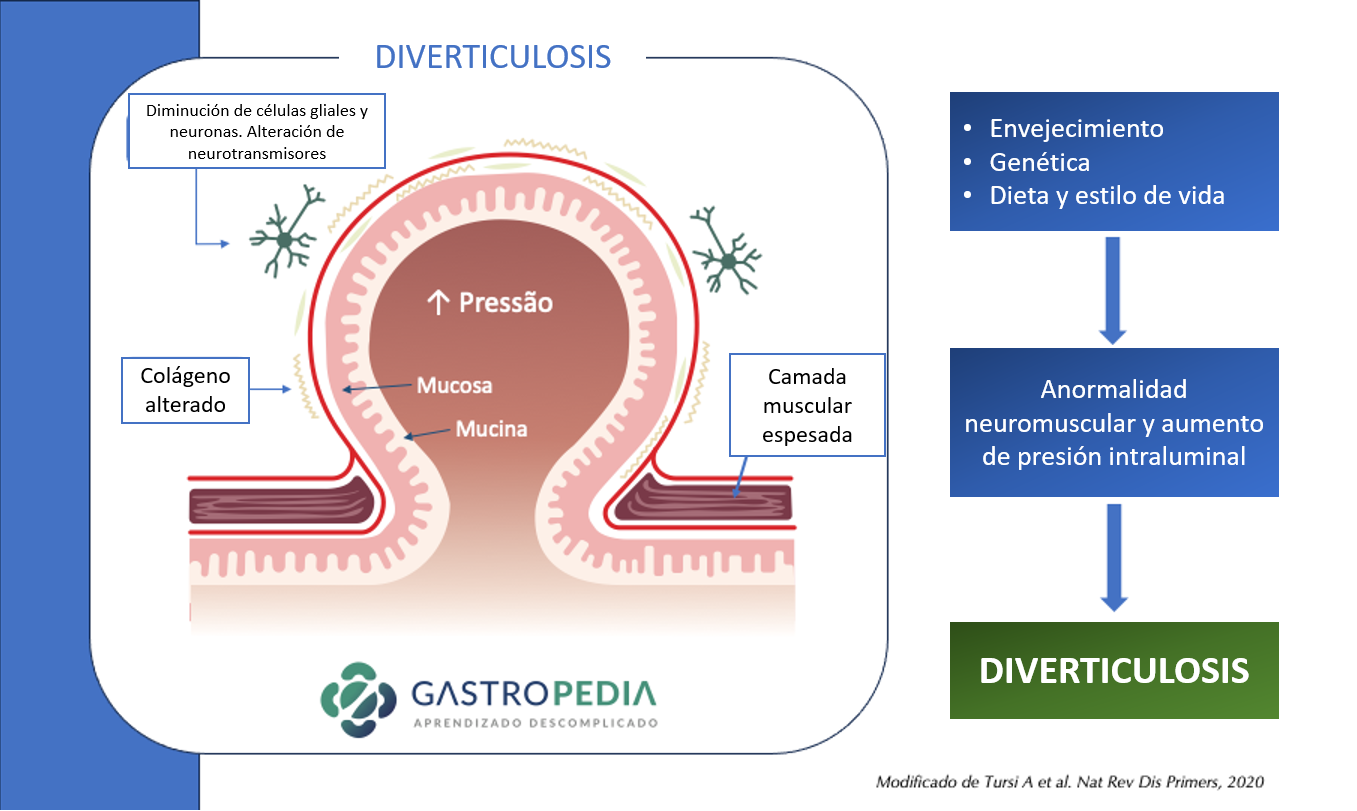 La principal hipótesis para la diverticulosis involucra anormalidades neuromusculares, con alteración en la composición del colágeno, en el sistema neuronal entérico, en un escenario de aumento de la presión intraluminal.
La principal hipótesis para la diverticulosis involucra anormalidades neuromusculares, con alteración en la composición del colágeno, en el sistema neuronal entérico, en un escenario de aumento de la presión intraluminal.
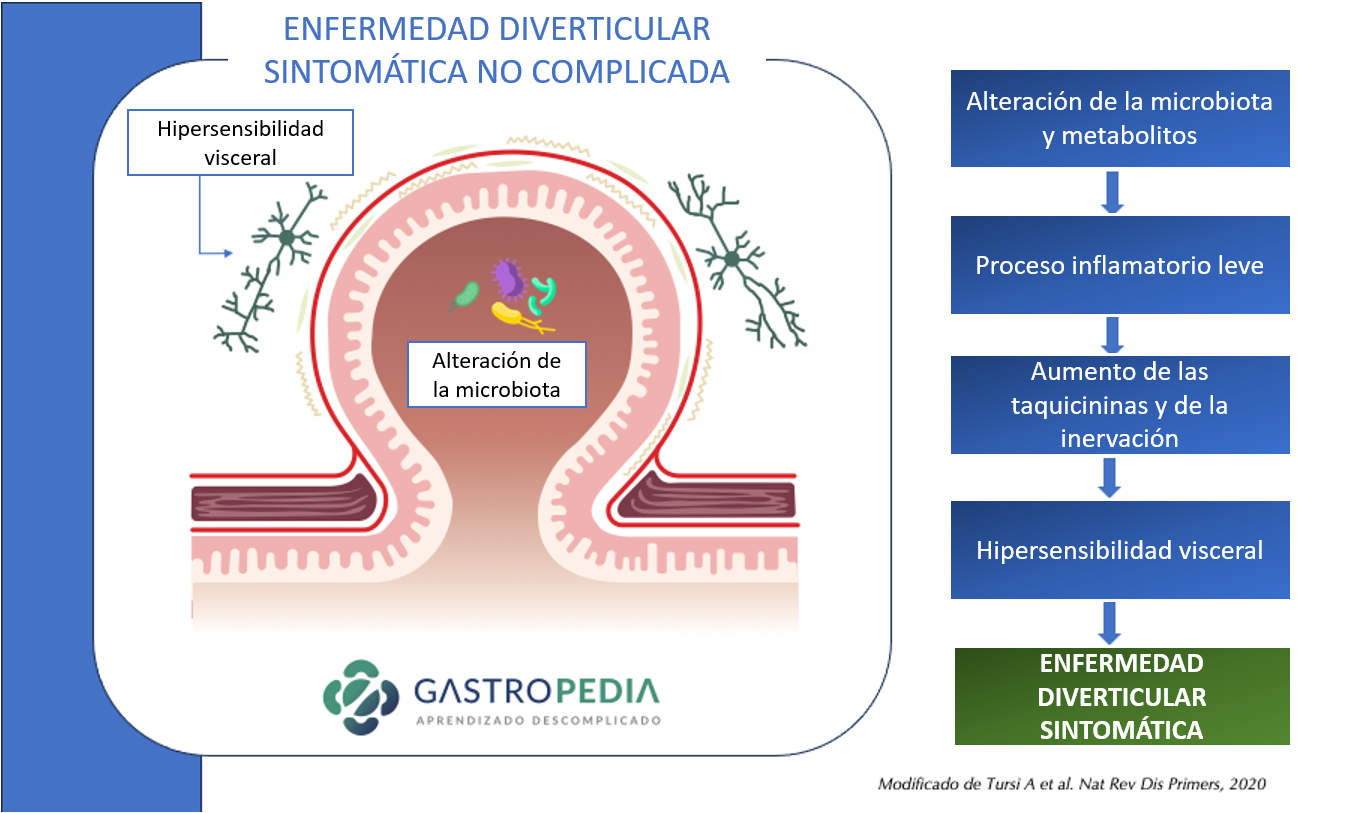
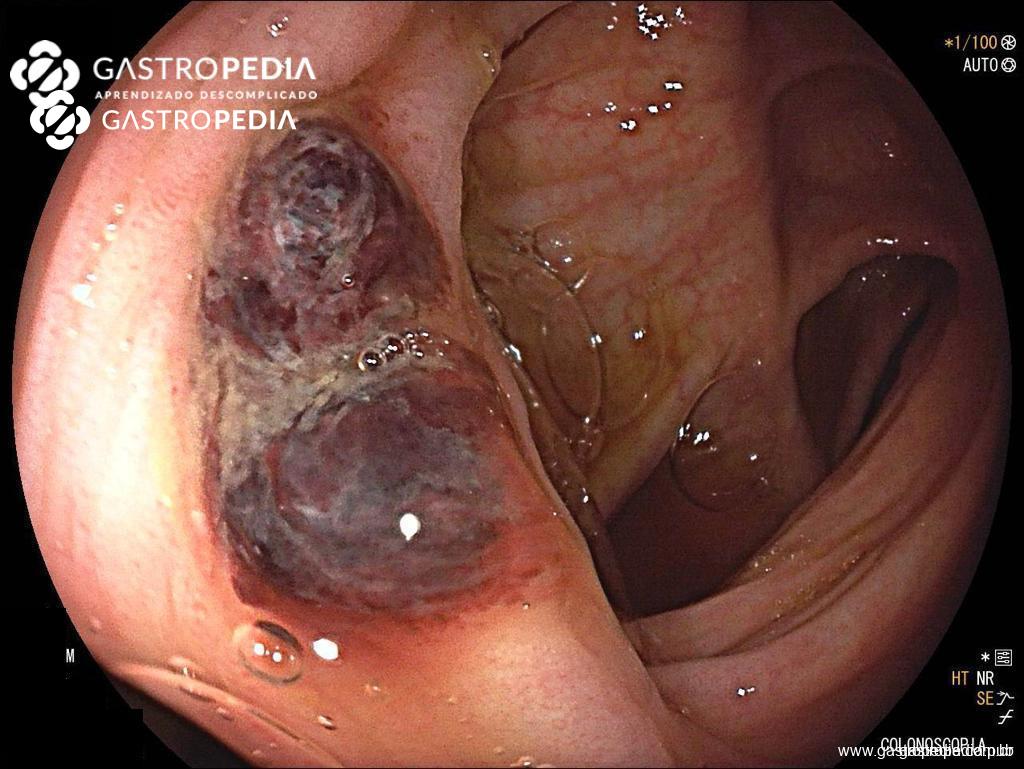
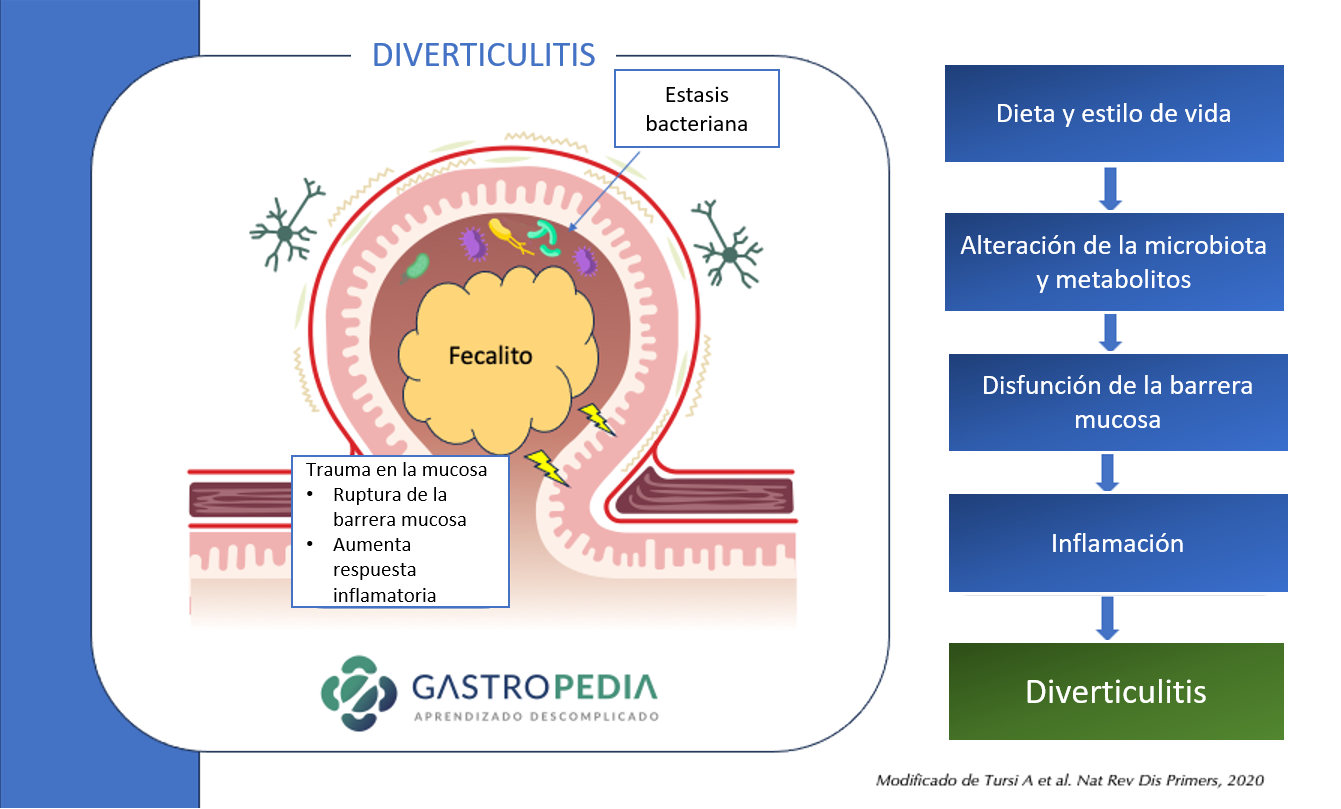 Los cambios en la microbiota, la pérdida de la función barrera, la inflamación y el traumatismo provocado por el fecalito son los principales mecanismos propuestos para la diverticulitis aguda.
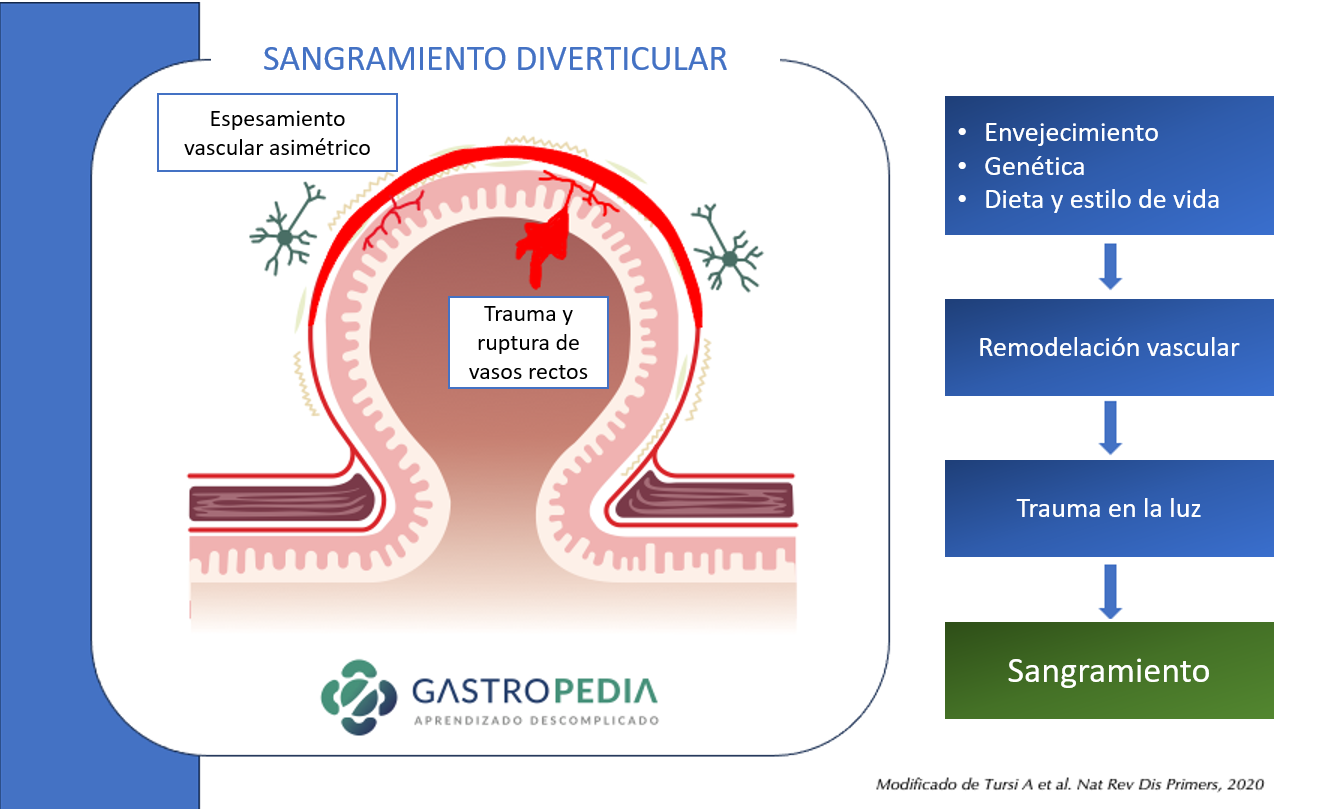
Los cambios en la microbiota, la pérdida de la función barrera, la inflamación y el traumatismo provocado por el fecalito son los principales mecanismos propuestos para la diverticulitis aguda.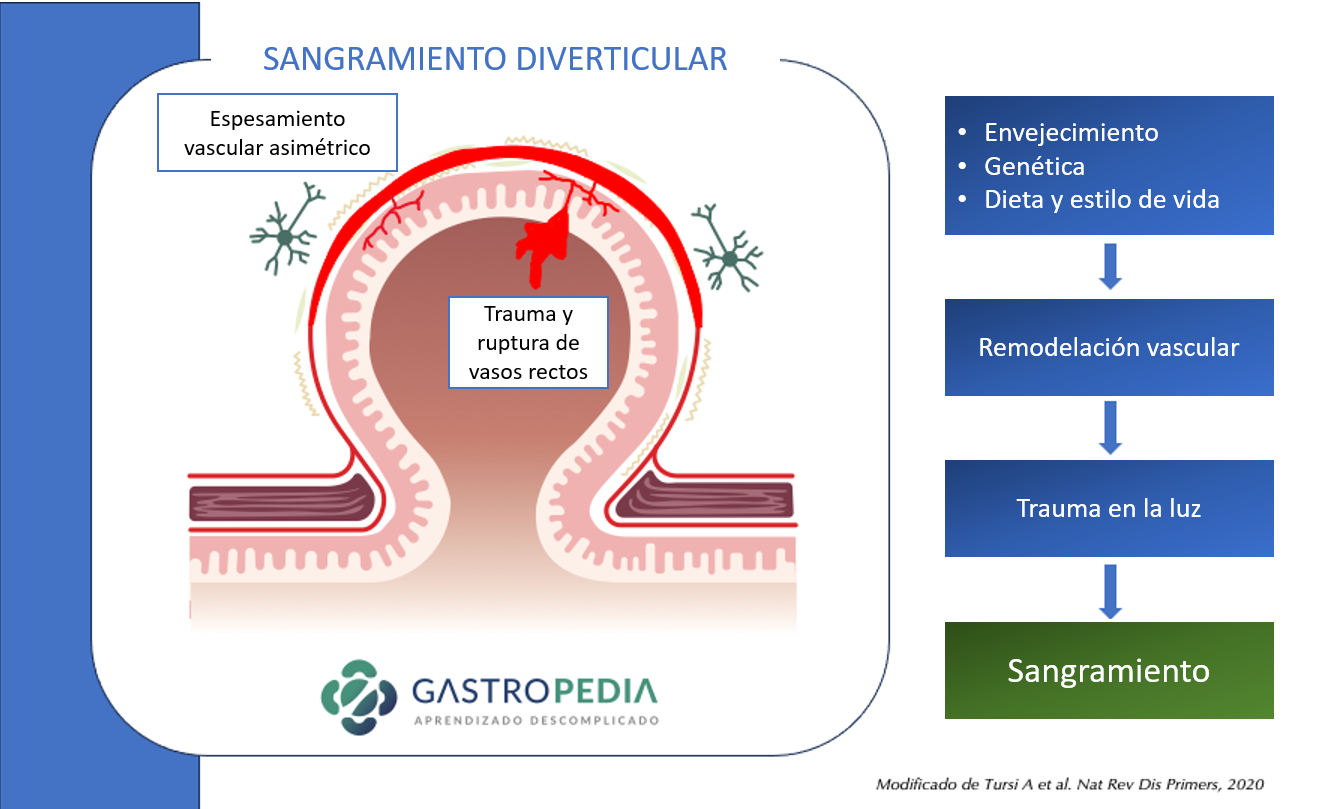 El sangrado diverticular ocurre en lugares con asimetría de vasos perforantes de mayor calibre. La obesidad, la hipertensión arterial y el trauma luminal se consideran factores de riesgo de hemorragia diverticular.
El sangrado diverticular ocurre en lugares con asimetría de vasos perforantes de mayor calibre. La obesidad, la hipertensión arterial y el trauma luminal se consideran factores de riesgo de hemorragia diverticular.