Insuficiencia Pancreática Exocrina: una mirada más allá de lo obvio
Cuando pensamos en Insuficiencia Pancreática Exocrina – IPE (disminución en la actividad de las enzimas pancreáticas en la luz intestinal, por debajo de los valores para una digestión normal) automáticamente relacionamos con problemas primarios del páncreas, como pancreatitis crónica o neoplasia pancreática. Y eso es correcto, estas patologías son causa de IPE. Sin embargo, tenemos varias otras causas que deben ser recordadas por el gastroenterólogo.
Para entender correctamente, vamos recurrir a la fisiología pancreática. La producción de enzimas digestivas por el páncreas no depende solo de la morfología de la glándula. Inicialmente, el páncreas es estimulado por vías neurales derivadas del nervio vago, y posteriormente tiene su principal vía de estimulación a través del paso del quimo por el duodeno. En esta fase, la liberación de secretina y colecistoquinina (CCK) es responsable de aproximadamente el 70% de toda la producción de jugo pancreático de esa comida. Por lo tanto, es correcto afirmar que cualquier falla en este circuito puede ser la causa de IPE.
Hoy clasificamos las etiologías de la IPE como de causas pancreáticas y extra-pancreáticas:
Entre las causas pancreáticas, tenemos:
- Pancreatitis crónica
- Neoplasias pancreáticas
- Fibrosis quística
- Resecciones pancreáticas
- Hemocromatosis
- Pancreatitis aguda grave, cursando con necrosis extensa del parénquima glandular
Y entre las causas extra-pancreáticas, podemos listar:
- Enfermedad Celíaca
- Enfermedad de Crohn de afección de intestino delgado alto
- Diabetes tipo I y II
- Envejecimiento pancreático
- Cirugías gastroduodenales
Las causas pancreáticas son más conocidas, y son causadas por enfermedades que llevan a fibrosis progresiva del páncreas, como la pancreatitis crónica; a la atrofia pancreática sumada a la obstrucción del conducto pancreático principal (como las neoplasias, especialmente de la región cefálica) y a la pérdida de parénquima pancreático, secundaria a pancreatitis aguda o resecciones pancreáticas. Además de ellas, la fibrosis quística es la principal enfermedad de causa genética y causa la liposustitución del parénquima pancreático, además de alteración en el transporte del jugo pancreático a través de los conductos.
Las causas no pancreáticas más bien establecidas son: la enfermedad celíaca (debido a la atrofia duodenal y la pérdida de la estimulación por las hormonas duodenales – secretina y CCK), la diabetes mellitus y las cirugías derivativas.
En los estudios más recientes, la diabetes ha sido señalada como causa de IPE, tanto la DM-1 como la DM-2. Las razones para esto son diversas e involucran:
- Atrofia del parénquima exocrino debido a la falta de insulina: la hormona producida por las células endocrinas pancreáticas ejerce una acción trófica paracrina en las células acinares. La disminución de la insulina causa disminución en el trofismo del parénquima exocrino.
- La diabetes puede llevar a neuropatía autonómica, perjudicando las vías vagales y la estimulación de la acetilcolina sobre las células pancreáticas.
- La microangiopatía que lleva a un curso de isquemia crónica en la glándula, disminuyendo la producción enzimática.
- La infiltración de adipocitos en el páncreas, además de linfocitos, aumenta la acción de fibroblastos y causa una mayor deposición de colágeno en el órgano.
La frecuencia de IPE en los diabéticos aún es incierta, y al parecer es mayor en los pacientes con DM-1 (30-56%) y menor en los pacientes con DM-2 (30-40%). A pesar de la heterogeneidad de los estudios, la prevalencia de IPE en los pacientes diabéticos no debe ser menospreciada.
En relación a los procedimientos quirúrgicos de abdomen superior, observamos una frecuencia cada vez mayor de IPE en gastrectomías, duodenopancreatectomías y cirugías derivativas, como el bypass gastrojejunal.
- En las gastrectomías parciales o totales tenemos estudios mostrando 30-73% de IPE después de 3 meses de la cirugía.
- Ya después de las duodenopancreatectomías ese porcentaje puede llegar al 100%, sin embargo, el promedio post-procedimiento indicado por neoplasia pancreática o periampular fue del 74%.
- Ese porcentaje es mayor que el encontrado en duodenopancreatectomías por enfermedades benignas (53%).
- Hay un trabajo que evidencia 16% de IPE post esofagectomía, aunque tiene un N pequeño.
Por último, la frecuencia de IPE post bypass gastrojejunal se ha mostrado una preocupación en el seguimiento de estos pacientes. Especialmente después de algunos años de cirugía, un porcentaje de estos pacientes puede presentar IPE. En una cohorte retrospectiva, el 20,6% de los pacientes tenían esteatorrea, pero solo el 10,3% de ellos fueron diagnosticados con IPE post bypass con reconstrucción en Y de Roux. Sin embargo, a pesar de que la frecuencia no es alta, el tratamiento de los pacientes con IPE diagnosticada es crucial para una evolución nutricional satisfactoria.
Como pudimos observar, las causas de Insuficiencia Exocrina Pancreática van más allá de problemas estructurales en la glándula. Es imperativo que el gastroenterólogo recuerde la IPE en los contextos presentados arriba, y que no deje pasar la oportunidad del tratamiento correcto de estos pacientes.
Referencias
- Vikesh K Singh, Mark E Haupt, David E Geller, Jerry A Hall, Pedro M Quintana Diez. Etiologías menos comunes de insuficiencia pancreática exocrina. World J Gastroenterol 2017 October 21; 23(39): 7059-7076
- Martha Campbell-Thompson, Teresa Rodriguez-Calvo, y Manuela Battaglia. Anormalidades del páncreas exocrino en la diabetes tipo 1. Curr Diab Rep. 2015 October ; 15(10): 79.
- J. R. Huddy, F. M. S. Macharg, A. M. Lawn, S. R. Preston. Insuficiencia pancreática exocrina después de esofagectomía. Diseases of the Esophagus (2013) 26, 594–597
- Miroslav Vujasinovic, Roberto Valente, Anders Thorell, Wiktor Rutkowski, Stephan L. Haas, Urban Arnelo, Lena Martin y J.-Matthias Löhr. Insuficiencia pancreática exocrina después de cirugía bariátrica. Nutrients 2017, 9, 1241;
- Joshua Y Kwon , Alfred Nelson , Ahmed Salih , Jose Valery, Dana M Harris, Fernando Stancampiano , Yan Bi. Insuficiencia pancreática exocrina después de cirugía bariátrica. Pancreatology, 2022 Nov;22(7):1041-1045.
Cómo citar este artículo
Marzinotto M, Gamarra ACQ. Insuficiencia Pancreática Exocrina: una mirada más allá de lo obvio. Gastropedia 2023, vol 1. Disponible en: https://gastropedia.pub/es/gastroenterologia/insuficiencia-pancreatica-exocrina-una-mirada-mas-alla-de-lo-obvio/
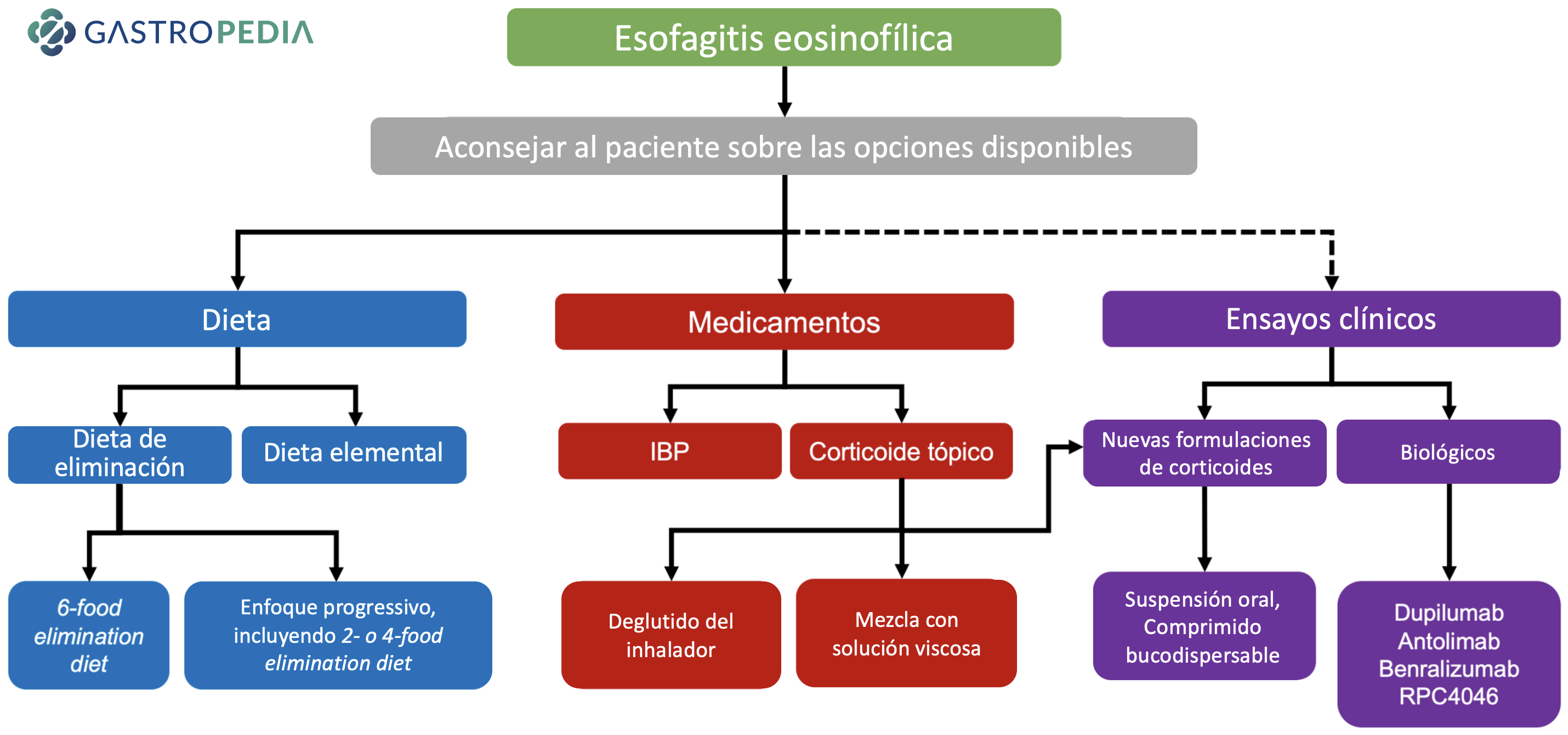 Figura 1: Diagrama de flujo de opciones para el tratamiento de la esofagitis eosinofílica. En el contexto apropiado, también puede ser necesaria la dilatación endoscópica. Adaptado de Beveridge & Falk (2020)[1]
Figura 1: Diagrama de flujo de opciones para el tratamiento de la esofagitis eosinofílica. En el contexto apropiado, también puede ser necesaria la dilatación endoscópica. Adaptado de Beveridge & Falk (2020)[1]