Nuevos medicamentos para la obesidad
Durante muchos años la limitada disponibilidad de opciones medicamentosas eficaces comprometió el tratamiento de la obesidad. Sabemos que el cambio del estilo de vida con mejores elecciones nutricionales, inclusión de actividad física, terapias comportamentales son importantes para prevención de la obesidad y también forman parte del tratamiento.
Es de suma importancia entender que una vez diagnosticada la obesidad, es necesario implementar medidas farmacológicas y en determinados casos medidas quirúrgicas para el tratamiento adecuado del paciente. Se observa actualmente una inercia en iniciar el tratamiento medicamentoso.
Por muchos años tuvimos pocas opciones medicamentosas para el tratamiento de la obesidad y muchas de ellas con registros de seguridad insatisfactorios. Sin embargo, en la última década, principalmente en los últimos 5 años, se están desarrollando nuevos medicamentos que proporcionan resultados importantes de pérdida de peso, asociado a mejora significativa del control metabólico, cardiovascular y renal.
El tratamiento medicamentoso debe ser individualizado y para eso necesitamos evaluar las contraindicaciones, tolerancia, seguridad y eficacia además del mecanismo de acción del fármaco versus el fenotipo de cada paciente.
Actualmente las medicaciones aprobadas por la Anvisa (Agencia Nacional de Vigilancia de la Salud en Brasil) para la obesidad son:
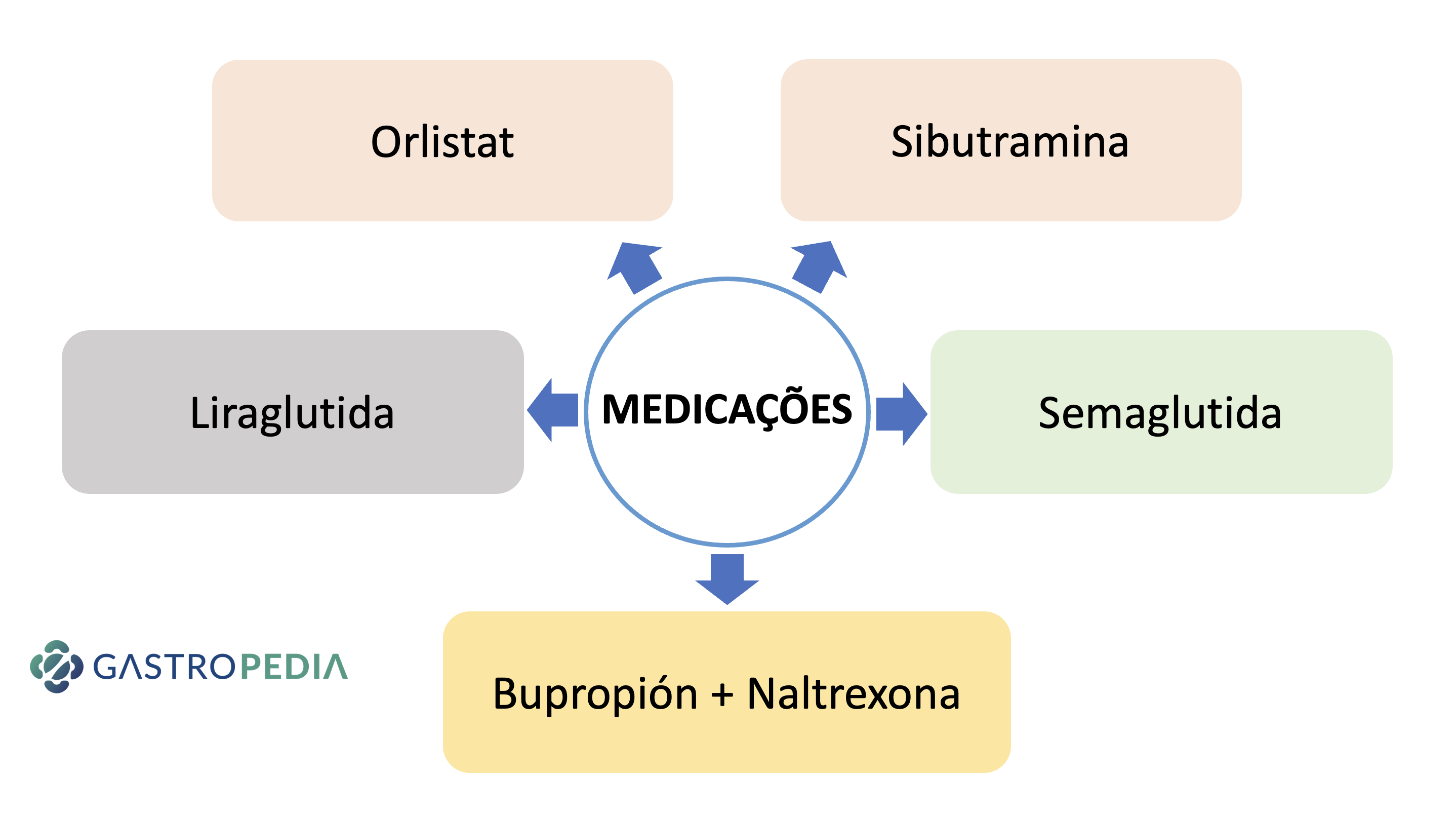
- ORLISTAT:
- Pérdida de peso discreta y reducción de 45% de evolución para la Diabetes Mellitus tipo 2 (DM2), en pacientes con intolerancia a la glucosa.
- SIBUTRAMINA:
- Pérdida ponderal alrededor de 4%;
- Contraindicaciones: enfermedad arterial coronaria, insuficiencia cardíaca congestiva, arritmia o accidente vascular cerebral
- NALTREXONA + BUPROPIÓN (CONTRAVE)
- Liberada por la Anvisa en 2023.
- Bupropión, un inhibidor de la reabsorción de dopamina y la naltrexona, un agonista del receptor de opioide, funcionan de forma sinérgica, disminuyendo la ingesta de alimentos y del peso corporal.
- Ensayos clínicos: COR-I, COR-II, COR-BMOD y COR-Diabetes revelan que la combinación de bupropión y naltrexona puede ser eficaz para una pérdida de peso entre de 5,0% a 9,3% en comparación con el grupo placebo dependiendo del estudio analizado.
Los agonistas del receptor de GLP-1 (GLP-1 RA), representados por Saxenda (Liraglutida 3mg) y Wegovy (Semaglutida 2,4mg), tienen un buen perfil de seguridad y tolerabilidad, proporcionando un tratamiento eficaz para reducción del peso y control glucémico, además varios estudios demostraron otros beneficios como reducción del riesgo de eventos cardiovasculares adversos mayores (MACE) en personas con y sin DM2 y más recientemente también protección renal.
La Liraglutida fue aprobada por la Anvisa para tratamiento de la obesidad hace años atrás, ya la Semaglutida fue aprobada en 2023.
- LIRAGLUTIDA
- Agonista del receptor de GLP-1 tiene 97% de homología al GLP-1 humano.
- Media vida de aproximadamente 13h; administración diaria.
- Entre varias acciones, estimula la liberación de insulina, dependiente de la glucosa, por el páncreas y retarda el vaciamiento gástrico.
- Efectos secundarios más comunes son gastrointestinales, entre ellos náuseas y vómitos.
- El estudio SCALE estudió Saxenda para el control de peso en personas sin DM2 y con DM2, los cuales 63,2% de los pacientes perdieron más de 5% de peso y 33,1% perdieron más de 10%.
- SEMAGLUTIDA
- Agonista del receptor de GLP-1 de segunda generación tiene 94% de homología al GLP-1 humano.
- Media vida de aproximadamente una semana; administración semanal, mejorando la adherencia del paciente y la calidad de vida.
- Estudio STEP: ocho ensayos clínicos principales con 2,4 mg de semaglutida evidenciando una pérdida media de aproximadamente 15% del peso corporal en 47% de los pacientes del grupo de semaglutida comparado a solo 4,8% del grupo placebo. Una reducción de 5% o más del peso ocurrió en 86,4% de los individuos en el grupo de la semaglutida.
- Estudio SELECT: reducción de 20% de eventos cardiovasculares adversos graves en pacientes sin DM2 en uso de 2,4mg de semaglutida. Este beneficio ya había sido evaluado en el estudio Leader con liraglutida, pero solo en pacientes con DM2.
- Estudio FLOW: reducción de 24% en la progresión de la enfermedad renal, así como en la muerte cardiovascular y renal para personas tratadas con semaglutida 1,0 mg en comparación con el placebo en personas con DM2 y ERC
Además de las nuevas medicaciones, Contrave y Wegovy aprobadas en 2023 por la ANVISA; más recientemente la Tirzepatida que ya fue aprobada por la ANVISA para uso en DM2, cuyo nombre comercial es Mounjaro, fue también aprobada por la FDA (Food and Drug Administration) para obesidad con el nombre de Zepbound.
- TIRZEPATIDA
- Agonista doble del receptor GIP y GLP-1 que tiene efecto sinérgico en la glucosa y control de peso.
- El Estudio SURMOUNT mostró una pérdida de peso de hasta 25% en un tercio de los individuos sin DM2 en uso de tirzepatida.
Existen varios otros estudios con nuevas drogas para obesidad en curso, el camino es prometedor para medicamentos triple agonistas entre otras drogas con nuevos mecanismos de acción.
Referencias
- Pi-Sunyer X, et al.A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med 2015:373;11–22.
- Davies MJ, et al. Efficacy of Liraglutide for Weight Loss Among Patients With Type 2 DiabetesThe SCALE Diabetes Randomized Clinical Trial JAMA 2015;314:687–699.
- le Roux CW, et al. 3 years of liraglutide versus placebo for type 2 diabetes risk reduction and weight management in individuals with prediabetes: a randomised, double-blind trial. Lancet 2017;389:1399–1409.
- Blundell J, et al. Effects of once-weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes Obes Metab 2017;19:1242–1251.
- Wilding JPH, et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Eng J Med. 2021;384:989–1002.
- Davies M, et al. Semaglutide 2,4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial. Lancet. 2021;397:971–84.
- Wadden TA, et al. J. Effect of Subcutaneous Semaglutide vs Placebo as an Adjunct to Intensive Behavioral Therapy on Body Weight in Adults With Overweight or Obesity: The STEP 3 Randomized Clinical Trial AMA. 2021;325:1403–1413.
- Rubino D, et al. Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity The STEP 4 Randomized Clinical Trial. JAMA. 2021;325:1414–1425.
- Marso SP, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2017;376:891–892.
- Ryan DH, et al. Semaglutide Effects on Cardiovascular Outcomes in People With Overweight or Obesity (SELECT) rationale and design Am Heart J. 2020;229:61–69.
- le Roux CW, et al. Tirzepatide for the treatment of obesity: Rationale and design of the SURMOUNT clinical development program. Obesity. 2023;31:96-110.
Como citar este artículo
Silva ACC, Cohen RV, Gamarra ACQ. Nuevos medicamentos para obesidad Gastropedia 2024; vol 2. Disponible en: https://gastropedia.pub/es/cirugia/nuevos-medicamentos-para-la-obesidad/